
【题目】某同学设计了如图实验装置探究硝酸的性质,根据图示判断下列结论不正确的是( )
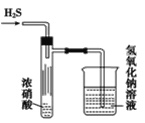
A.试管内壁上的“黄霜”的成分是硫
B.该实验既说明了浓硝酸具有氧化性,又说明了浓硝酸具有挥发性
C.烧杯内氢氧化钠溶液的作用是除去尾气,防止尾气毒害
D.试管中浓硝酸可以用浓盐酸代替
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g),反应过程中的能量变化如图所示,下列说法正确的是( )
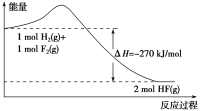
A.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量为270 kJ
B.氟化氢气体分解生成氢气和氟气的反应是放热反应
C.在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量
D.其他条件不变,加入催化剂,该反应的ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的判断和表示方法正确的是( )
A.由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ·mol-1,可知:金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,可知:含1 mol/L CH3COOH的溶液与含1mol/L NaOH的溶液混合,放出热量等于57.3 kJ
D.2gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为H2(g)+![]() O2(g) =H2O(l) ΔH=-285.8 kJ/mol
O2(g) =H2O(l) ΔH=-285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。已知:CO(g)+H2O(g)H2(g)+CO2(g)平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
试回答下列问题:
(1)上述正向反应是________反应 (填“放热”或“吸热”);
(2)下列条件的改变能加快其反应速率的是_______(选填序号);
①升高温度;②保持体积不变,只增加CO的质量;③保持体积不变,充入Ne使体系压强增大;④保持压强不变,充入Ne使容器的体积增大
(3)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2,发生反应CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度,压强的关系如下图所示:
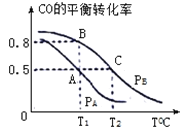
①A、B两点对应的压强大小关系是PA________PB;(填“>”,“<”,“=”)
②A、B、C三点的平衡常数KA、KB、KC的大小关系是 ____________;
③在P1压强、T1℃时,该反应的平衡常数K=___________;
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正 ____ v逆(填 >、< 或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)常温下,回答下列问题:(提示:lg2 = 0.3)
(1)pH=4的硫酸溶液中,由水电离出的氢离子浓度为____________________________;
(2)将pH=11的氢氧化钡稀释105倍后pH为____________________________________;
(3)将pH=11的氨水稀释100倍后pH范围为___________________________________;
(4)将pH=2的盐酸与pH=5的硫酸等体积混合后pH为__________________________;
(5)pH=a的盐酸与pH=b的氢氧化钠混合后pH=7,且a+b=13,则V酸:V碱=________。
(II)反应A(s)+2B(g)2C(g)在密闭容器中达到平衡。
(1)若升高温度能使C的物质的量减小,则正反应是___(填“吸热”或“放热”)反应。
(2)若增加A的物质的量,平衡________(填“正向”或“逆向”或“不”)移动。
(3)若增大压强,平衡________(填“正向”或“逆向”或“不”)移动。
(4)若增加C的浓度,B(g)的转化率________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)
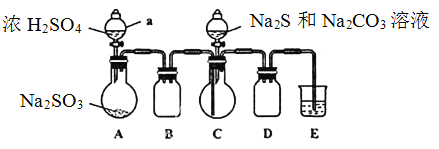
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是____;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经____(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是_______。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过_____方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A.多电子原子轨道能量高低:4s>3p>3s>2px=2py
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:NaCl>SiO2>Hg>P4
D.晶格能由大到小:KF>KCl>KB>KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH- △H>0,下列叙述正确的是
H++OH- △H>0,下列叙述正确的是
A. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)
4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是

A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
C. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
D. 氮气氧化为NO的热化学方程式为:N2(g)+O2(g)![]() 2NO(g)△H=-181.5kJ/mol
2NO(g)△H=-181.5kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com