
����Ŀ��X��Y��Z��U��W ��ԭ���������������ǰ������Ԫ�ء����� Y ��ԭ�Ӻ����� 7 ���˶�״̬��ͬ�� ���ӣ�X��Z ��δ�ɶԵ�������Ϊ 2��U �ǵ�������Ԫ���γɵļ������а뾶��С��Ԫ�أ�W ���ڲ�� ��ȫ�����������ֻ�� 1 �����ӡ���ش��������⣺
��1��U �����ڱ��е�λ�� ��X��Y��Z �ĵ�һ�����ܴӴ�С��˳���� ����Ԫ�ط��ű�ʾ����ͬ)��
��2��д�� W �ļ۵����Ų�ͼ ��
��3�����ݵȵ�����ԭ������֪������ XZ �ĵ���ʽ�� ��
��4��X��Y��Z������⻯��ļ��ǴӴ�С��˳���� �� �û�ѧʽ��ʾ)�� ԭ�� �� ��
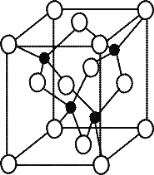
��5����Ԫ�� Y �� U Ԫ����ɵĻ����� A�������ṹ����ͼ��ʾ�������ʾ Y ԭ�ӣ� �����ʾ U ԭ�ӣ�����д�������� A �Ļ�ѧʽ ������ Y Ԫ�ص��ӻ���ʽ�� ��
��6��U �ľ�����������ϵ���侧���߳�Ϊ 405 pm���ܶ��� 2.70 g/cm��ͨ������ȷ�� �侧�������� ����������ѻ������������ѻ��������������ܶ� ��������֪��4053��6.64��107��
���𰸡���1���������� IIIA ��(1 ��) N��O��C(1��)
��2��
��3��![]() ��4����4��CH4��NH3��H2O
��4����4��CH4��NH3��H2O
�����⻯�������ԭ�Ӽ۲���Ӷ�����Ϊ�ģ�VSEPR ģ�;�Ϊ���������Σ�������ԭ�ӵŵ��� ������������������֮��ļ��DZ�С��5��AlN sp3 (1 ��)��6�������������ܶѻ�
��������
���������X��Y��Z��U��W��ԭ���������������ǰ������Ԫ�أ�����Y��ԭ�Ӻ�����7���˶�״̬��ͬ�ĵ��ӣ���YΪNԪ�أ�U�ǵ�������Ԫ���γɵļ������а뾶��С��Ԫ�أ���UΪAl��X��Z��δ�ɶԵ�������Ϊ2��X��ԭ������С��N����Z��ԭ����������N��Al֮�䣬X��Z�ĺ�������Ų��ֱ�Ϊ1s22s22p2��1s22s22p4����XΪCԪ�ء�ZΪOԪ�أ�W���ڲ����ȫ�����������ֻ��1�����ӣ�ԭ����������Al��ֻ�ܴ��ڵ������ڣ����������Ϊ2+8+18+1=29����WΪCuԪ�ء�
��1����Ԫ�������ڱ��е�λ������������ IIIA�壻ͬ������ԭ����������һ�����ܳ��������ƣ���NԪ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������N��O��C��
��2��WΪCuԪ�أ��۵����Ų�ʽΪ3d104s1���۵����Ų�ͼΪ�� ��
��
��3�����ݵȵ�����ԭ������֪������CO��N2��Ϊ�ȵ����壬����ʽΪ![]() ��
��
��4��X��Y��Z������⻯��ֱ�ΪCH4��NH3��H2O��3���⻯�������ԭ�Ӽ۲���Ӷ�����Ϊ4��VSEPRģ�;�Ϊ���������Σ�������ԭ�ӵŵ��Ӷ������������¼��DZ�С���ʼ��ǣ�CH4��NH3��H2O��
��5��������Nԭ����ĿΪ4��Alԭ����ĿΪ8��1/8+6��1/2=4���ʸû����ﻯѧʽΪAlN��Yԭ���γ�4�����ۼ�����Yԭ���ӻ���ʽΪsp3��
��6���辧����Alԭ����ĿΪN��Al������N��Al����27/6.02��1023g=��405��10-10��3��2.70g/cm3�����N��Al��=4.00�������侧�����������������ܶѻ���


 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��I2��һ���������ܷ�����Ӧ��H2(g)��I2(g)![]() 2HI(g) ��H����a kJ��mol��1
2HI(g) ��H����a kJ��mol��1
��֪��

(a��b��c��������)
����˵������ȷ����
A. ��Ӧ��������������������������
B. �Ͽ�1 mol H��H����1 mol I��I�������������ڶϿ�2 mol H��I����������
C. �Ͽ�2 mol H��I����������ԼΪ(c��b��a)kJ
D. ���ܱ������м���2 mol H2��2 mol I2����ַ�Ӧ��ų�������С��2a kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��пͭԭ���װ����ͼ��ʾ�����������ӽ���Ĥֻ���������Ӻ�ˮ����ͨ���������й�������ȷ����
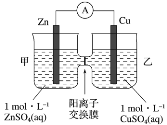
A��п�缫�Ϸ�����ԭ��Ӧ
B����ع���һ��ʱ��׳ص� c(SO42��)����
C����ع���һ��ʱ����ҳ���Һ������������
D���������ӷֱ�ͨ������Ĥ���������ƶ���������Һ�е��ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3.24g������ȫˮ�����������ǵ������ǣ� ��
A. 5.04g B. 3.6g C. 6.48g D. 3.24g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������أ�K2FeO4����һ�ּ�������������������һ������Ͷ��ˮ������������������ �ȶ��Բ�Ʊ�������ʪ�����ɷ����֣���ԭ�����±���ʾ��
ʪ���������������£�
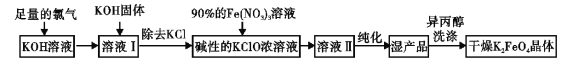
�ش��������⣺
��1��K2FeO4 ��Fe�Ļ��ϼ� ��ʵ���Ҹɷ��Ʊ���ѡ�õ�������
A�������� B�������� C������������ D���մ�����
(2)���¶Ƚϸ�ʱKOH��Cl2��Ӧ���ɵ���KClO3��д�����¶Ƚϸ�ʱKOH��Cl2��Ӧ�Ļ�ѧ����ʽ
___________________��
��3������Һ I �м���KOH �����Ŀ����
A��ʹ KClO3 ת��Ϊ KClO
B��Ϊ��һ����Ӧ�ṩ���ԵĻ���
C��KOH �����ܽ���ȣ���������߷�Ӧ����
D������Һ I �й����� Cl2 ������Ӧ�����ɸ���� KClO
��4����������ǿ��Ũ��Һ�м��� 90%�� Fe��NO3��3��������Ӧ�����ӷ���ʽΪ��
�� Fe3��+3OH���TFe(OH)3���� ��
��5�����������������ˮϴ��ʪ��Ʒ������ϴȥ�����⣬���ŵ��� ��
��6������ж� K2FeO4 �����Ѿ�ϴ�Ӹɾ� ��
��7��������أ�K2FeO4����Ϊˮ���������ŵ�֮һ���ܳ�ȥ�������ʣ���ƽ�÷�Ӧ�����ӷ���ʽ��
____FeO42��+ H2O= Fe��OH��3�����壩+ O2��+ �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ��������Ŀ��ȵ���( )
A. �����ʵ�����ˮ����ˮ���е�������
B. �����ʵ�������ϩ�ͱ�ϩ�к��еĹ��õ��Ӷ���
C. ͬ�¡�ͬѹ��ͬ�����CO��NO���е�������
D. �����ʵ������Ʒֱ��������������Ӧ���ɵ������ƺ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T0Cʱ����һ�����Ϊ2L�������У�A�����B���巴Ӧ��Ӧ����C���壬��Ӧ������A��B��CŨ�ȱ仯��ͼ��ʾ��
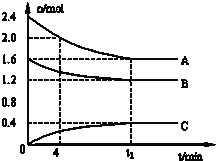
��1�� д���÷�Ӧ�ķ���ʽ��_______________
��2�� ������¶��¸÷�Ӧ��ƽ�ⳣ����_______________
��3�� ��֪��K��300������K��350�������÷�Ӧ��____________�ȷ�Ӧ��
��4�� 0��4����ʱ��B��ƽ����Ӧ����Ϊ��_______________
��5�� ����ƽ��ʱA��ת����Ϊ��_______________
��6�� ���������£����д�ʩ����ʹn��A��/n��C�����͵���____________��
A�����뺤�� B��ʹ�ô���
C���ٳ���2.4molA��1.6molB D�������¶ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�����ӷ���ʽ�У���ȷ���ǣ�
A. ����ı�ȼ����Ϊ890.3kJ.mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O��g�� ��H=-890.3kJ.mol-1
B. CO��g����ȼ������283.0 kJ/mol ����CO2��g��=2CO��g��+O2��g���ķ�Ӧ����H=+2��283.0 kJ/mol
C. NaOH��HCl��Ӧ���к��� ��H=-57.3kJ/mol����H2SO4��Ca��OH��2��Ӧ���к�����H=2����-57.3��kJ/mol
D. 500����30MPa�£���0.5mol N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3��g��������19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��![]() 2NH3��g�� ��H=-38.6kJ/mol
2NH3��g�� ��H=-38.6kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com