


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
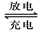 2PbSO4+2H2O
2PbSO4+2H2O查看答案和解析>>
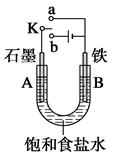
科目:高中化学 来源:不详 题型:填空题
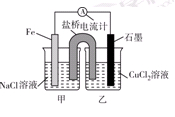
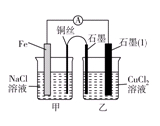
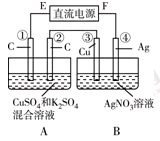
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在原电池中,化学能转变为电能,电子沿导线由正极流向负极 |
| B.双液原电池通过盐桥连接,KCl盐桥中K+朝正极定向迁移 |
| C.在电解池中,与电源负极相连的电极称为阳极,溶液中阴离子朝阳极定向迁移 |
| D.电解氯化铜溶液,在阴极上产生的气体能使湿润的KI-淀粉试纸变蓝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.生铁抗腐蚀能力比纯铁强 |
| B.钢瓶在储存液氯前彻底干燥可减缓腐蚀 |
| C.水库铁闸与直流电源正极相连可减缓腐蚀 |
| D.常温下浓硝酸比浓盐酸更易使铁腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
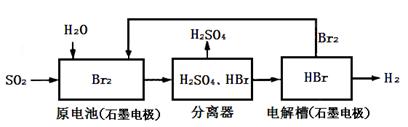
| A.电解槽中也可以用铁电极代替石墨作为阳极 |
| B.原电池中负极的电极反应为:SO2+2H2O+4e-=SO42-+4H+ |
| C.该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4 |
| D.该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钢铁的析氢腐蚀和吸氧腐蚀负极反应相同,正极反应不同 |
| B.镀锌铁皮和镀锡铁皮破损后,前者更易被腐蚀 |
| C.将铁件与电源正极相连,可实现电化学保护 |
| D.将钢管与铜管堆放在一起,可保护钢管少受腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。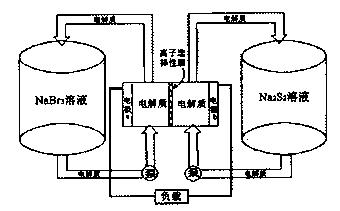
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xLi++R。下列有关说法正确的是
xLi++R。下列有关说法正确的是| A.放电时,该电池将电能转化为化学能 | B.充电时,Rx+由阴极向阳极移动 |
| C.放电时,负极反应为xLi-xe-==xLi+ | D.充电时,阳极反应为R-xe-==Rx+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com