
【题目】联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下:
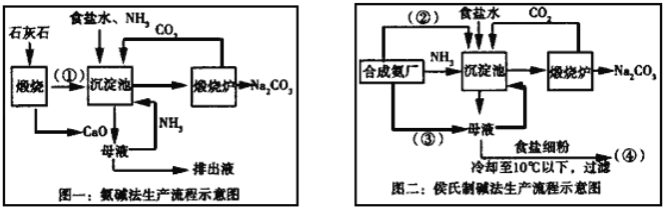
完成下列填空:
(1)写出化学式:②_____、③____
(2)从理论上分析,氨碱法生产过程中_____(选填“需要”、“不需要”)补充氨气,写出该工艺中生成CaCl2的化学方程式________________。
(3)对联碱法中从母液中提取氯化铵晶体的过程进行分析,所得结论合理的是______。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气可把碳酸氢钠转化为碳酸钠,防止碳酸氢钠析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(4)取“侯氏制碱法”生产的纯碱样品5.500g,配成500mL溶液,取25mL溶液用0.1000mol/L的标准盐酸滴定(设其中的杂质不与盐酸反应),用酚酞作指示剂,三次滴定消耗盐酸的平均量为25.00mL.计算样品中纯碱的质量分数______。(已知25℃时0.1mol/L的NaHCO3溶液的pH约为8.3)某活动小组根据上述制碱原理,用如下所示装置(夹持装置省略)制备碳酸氢钠.
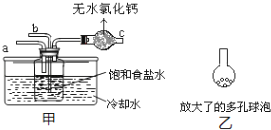
(5)实验时,须先从____管通入_____气体,再从_____管中通入_____气体。
(6)有同学建议在甲装置的b管下端连接乙装置,目的是________________________________。
【答案】CO2 NH3 不需要 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O b 96.4% a 氨气 b 二氧化碳 增大二氧化碳与溶液接触面积,使其充分反应
【解析】
(1)根据流程图分析;
(2)氨碱法生产过程中,母液中加入氧化钙反应生成的氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用;氢氧化钙与氯化铵反应生成氯化钙、氨气和水;
(3)根据母液中通入氨气、食盐会析出氯化铵晶体进行分析;
(4)用酚酞作指示剂,盐酸滴定碳酸钠溶液,根据反应方程式计算;
(5)通氨气时要防止倒吸,则导管不能直接深入液面以下,由于二氧化碳的溶解度较小,要先通氨气;
(5)多孔球泡能增大二氧化碳与溶液的接触面积。
(1)联碱法生产流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵,所以通入沉淀池中的是二氧化碳,即②为CO2,母液中通入氨气再重新利用,则③为NH3;
(2)从理论上分析,氨碱法生产过程中,母液中加入氧化钙反应生成氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气;
CaO与水反应生成氢氧化钙,氢氧化钙与氯化铵反应生成氯化钙,则该工艺中生成CaCl2的化学方程式Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;
(3)a.常温时氯化铵的溶解度比氯化钠大,故a错误;
b.通氨气能增大NH4+的浓度,使NH4Cl更多地析出,使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故b正确;
c.加入食盐细粉目的是提高Cl﹣的浓度,促进氯化铵结晶析出,故c错误;
(4)已知25℃时0.1mol/L的NaHCO3溶液的pH约为8.3,则用酚酞作指示剂滴定时,发生的反应为Na2CO3+HCl=NaHCO3+NaCl,
则n(Na2CO3)=0.1000mol/L×0.025L×![]() =0.05mol,
=0.05mol,
m(Na2CO3)=nM=0.05mol×106g/mol=5.3g,
样品中纯碱的质量分数:![]() ×100%=96.4%;
×100%=96.4%;
(5)向溶液中通氨气时要防止倒吸,则导管不能直接深入液面以下,由于二氧化碳的溶解度较小,要先通氨气,则先由a管通入氨气,再由通入二氧化碳;
(6)在甲装置的b管下端连接多孔球泡,能增大二氧化碳与溶液的接触面积,使二氧化碳充分溶解。


科目:高中化学 来源: 题型:
【题目】甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,甲中电极为锌片和铜片,乙中电极为石墨棒C1、C2,丙中电极为石墨棒C3、铁片,电极之间用导线相连。则下列叙述不正确的是
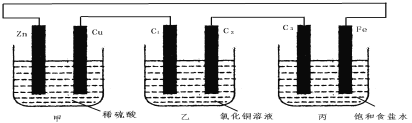
A.甲是化学能转变为电能,乙、丙是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、C3上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲中溶液的pH逐渐升高,乙、丙中溶液的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B | 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 | 先出现白色沉淀后又生成红褐色沉淀 | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
C | 在滴有酚酞的Na2CO3溶液中, 加入BaC12 | 溶液红色褪去 | CO32-在溶液中存在水解平衡 |
D | 常温下,测定盐酸和醋酸溶液的pH | 盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如右图所示,下列有关叙述正确的是( )
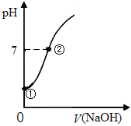
A. ①点所示溶液中只存在HClO的电离平衡
B. ①到②水的电离程度逐渐减小
C. I-能在②点所示溶液中存在
D. ②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪前,黑火药是世界上唯一的火箭推进剂,黑火药爆炸的化学方程式为:S + 2KNO3 +3C = K2S +N2↑ +3CO2↑。20世纪60年代,火箭使用的是液体推进剂,常用的氧化剂有四氧化二氮、液氧等,可燃物有肼(N2 H4)、液氢等。
(1)K原子核外电子云有___种不同的伸展方向,电子填充了__个轨道;写出硫原子的核外电子排布式__,比较反应所涉及的原子的原子半径大小:__;
(2)写出产物中含极性键的非极性分子的结构式__,产物K2S的电子式为___;
(3)已知S和氯水反应会生成两种强酸,其离子方程式为_______;
(4)以上的火箭推进剂一般含有氮元素,含氮化合物种类丰富。有一含氮化合物,具有很强的爆炸性,86g该化合物爆炸分解会生成标况下N267. 2L和另一种气体单质H2。写出其爆炸的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCl2和NaHCO3按物质的量之比为1:2混合制成溶液,加热蒸干灼烧后得到的固体是( )
A.Mg(HCO3)2、NaClB.MgO、NaClC.MgCl2、Na2CO3D.MgCO3、NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,发生如下反应:4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)
完成下列填空:
(1)写出该反应的平衡常数表达式K=______。若只改变一个影响化学平衡的因素,则下列关于平衡常数K与化学平衡移动关系的叙述正确的是______(填序号)。
a.K值不变,平衡不移动
b.K值变化,平衡一定移动
c.平衡移动,K值可能不变
d.平衡移动,K值一定变化
(2)若反应在恒容密闭容器中进行,能说明该反应已达到平衡状态的是_____(填序号)。
a.υ正(NO2)=2υ正(NO)
b.NO和Cl2的物质的量之比不变
c.混合气体密度保持不变
d.c (NO2):c (NO):c (Cl2)=4:2:1
(3)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.4mol NO2和适量NaCl固体,10min时反应达到平衡.测得10min内υ(NO2)=0.015mol/(Lmin),则平衡后n (Cl2)=______mol,此时NO2的转化率为а1;保持其它条件不变,扩大容器的体积,当反应再次达到平衡时NO2的转化率为а2,则а2_____а1(选填“>”、“<”或“=”)。
实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得到1L溶液A,溶液B为0.1mol/L的CH3COONa溶液。
(4)两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为________________。
(5)可使溶液A和溶液B的pH相等的方法是__________(填序号)。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素燃料电池既能去除城市废水中的尿素,又能发电。尿素燃料电池结构如下图所示,甲电极上发生如下反应:CO(NH2)2+ H2O-6e-→CO2+N2+6H+,则
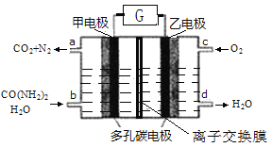
A.甲电极是阴极
B.电解质溶液可以是KOH溶液
C.H+从甲电极附近向乙电极附近迁移
D.每2molO2理论上可净化1molCO(NH2)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com