
【题目】FeSO4受热分解的化学方程式为: 2FeSO4Fe2O3+SO2↑+SO3↑
请回答:
(1)将FeSO4受热产生的气体按图示装置进行实验,证实含有SO3和SO2。能说明SO2存在的实验现象是;为测定BaSO4沉淀的质量,后续的操作步骤依次为、洗涤、干燥、称重。
(2)设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)。
【答案】
(1)品红溶液褪色;过滤
(2)取适量固体,家足量的稀盐酸溶解,分成两份,一份中滴加KSCN溶液,若是血红色,则有Fe3+ , 说明含有Fe2O3 ;另外一份滴加BaCl2溶液,若有白色沉淀,则有SO42- , 说明含有未分解的FeSO4
【解析】解:本题的难点在于受热后固体成分的分析,易忽略未分解FeSO4的检验,可以检验Fe2+ 或SO42- , 前者受Fe3+干扰不易检验,所以检验SO42-的存在。答题时需要注意语言的规范性,答题模式为“取少量·····,加盐酸溶解,滴加······试剂,出现···现象,得出······结论”,需要多种离子检验时考虑分成多份分别检验。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有下列物质:①干冰 ②NaHCO3晶体③氨水④纯醋酸⑤FeCl3溶液 ⑥铜 ⑦Fe(OH)3胶体 ⑧蔗糖,
(1)其中属于电解质的是 ,
(2)写出FeCl3的电离方程式: ,
(3)写出NaHCO3(aq)与稀盐酸反应的离子方程式: ,
(4)胶体是一种常见的分散系,回答下列问题.①向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为 .
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做胶体的聚沉.
③区分胶体和溶液常用的方法叫做 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2O2与CO2的反应中,下列说法正确的是
A.该反应中Na2O2是氧化剂,CO2是还原剂
B.1mol Na2O2参加反应,有2mole-转移
C.Na2O2晶体中阴阳离子个数比为1:2
D.CO2分子中含有极性键和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2。下列叙述中错误的是
A. 化学反应速率:乙>甲 B. 平衡混合气中H2的体积分数:乙>甲
C. H2的转化率:乙>甲 D. 平衡后N2的浓度:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·Lˉ1 , C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。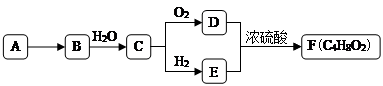
请回答:
① 有机物D中含有的官能团名称是________。
②D+E→F的反应类型是________。
③有机物A在高温下转化为B的化学方程式是________。
④ 下列说法正确的是________。
A.有机物E与金属钠反应比水与金属钠反应要剧烈
B.有机物D、E、F可用饱和Na2CO3溶液鉴别
C.实验室制备F时,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρ g/ml,质量分数为w,物质浓度为cmol/L,则下列关系中不正确的是( )
A.ρ= ![]()
B.W= ![]()
C.W= ![]()
D.C= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类: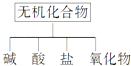
(1)如图所示的物质分类方法名称是 .
(2)以Na、K、H、O、C、S中任意两种或三种元素组成合适的物质,分别填在表②③⑥的后面.
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl | ③ | ⑤Na2CO3 | ⑦CO2 |
(3)写出⑦转化为⑤的离子方程式: .
(4)实验室制备⑦常用和反应(写物质的化学式),检验该气体的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
请回答:
(1)仪器A的作用是;冰水浴冷却的目的是(写两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因。
(3)Clˉ存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①(用离子方程式表示),②H2O2+Cl2===2Clˉ+O2+2H+。
(4)H2O2浓度对反应速率有影响。通过图2所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是 , 馏出物是。
(5)抽滤法分离NaClO2过程中,下列操作不正确的是( )
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下.NH4Cl溶液加水稀释, ![]() 增大
增大
B.0.1mol/LNa2CO3溶液加热后,溶液的pH减小
C.室温下稀释O.lmol/LCH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小
D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com