
����Ŀ���������⡿ClO2��һ����������������Ũ�ȹ���ʱ�����ֽ⣬�������Ƴ�NaClO2���壬�Ա���������档�������ⷨ�Ʊ�NaClO2�����ʵ��װ����ͼ1��ʾ��
��֪��2NaClO3��H2O2��H2SO4===2ClO2����O2����Na2SO4��2H2O
2ClO2��H2O2��2NaOH===2NaClO2��O2����2H2O
ClO2�۵㣭59�桢�е�11�棻H2O2�е�150��
��ش�
��1������A������������ˮԡ��ȴ��Ŀ����(д����)��
��2���������ٹ���������������NaClO2���ʣ��Խ�����ԭ����
��3��Cl������ʱ���ClO2�����ɡ���Ӧ��ʼʱ��������ƿ�м����������ᣬClO2���������ʴ����ߣ����������������ù��̿��ܾ�������Ӧ��ɣ����䲹����������(�����ӷ���ʽ��ʾ)����H2O2��Cl2===2Cl����O2��2H+��
��4��H2O2Ũ�ȶԷ�Ӧ������Ӱ�졣ͨ��ͼ2��ʾװ�ý�����30% H2O2��ҺŨ����40%��B��Ӧ����һ���豸�����豸�������� �� ���������
��5�����˷�����NaClO2�����У����в�������ȷ���ǣ���������
A.Ϊ��ֹ��ֽ����ʴ���ò�����ά������ֽ���г���
B.��ת����Һ��©��������Һ������ʱ��ת�Ƴ���
C.ϴ�ӳ���ʱ��Ӧʹϴ�Ӽ�����ͨ������
D.������ϣ��Ͽ�ˮ��������ƿ�����Ƥ�ܺر�ˮ��ͷ
���𰸡�
��1����ֹ����������˫��ˮ�ֽ⡢���ClO2���ܽ�ȡ�����NaClO2�ܽ�ȡ���ֹClO2�ֽ�
��2���������ٹ���ClO2��Ӧ����֣��������ٹ���ClO2Ũ�ȹ��������ֽ�
��3��2ClO3�� ��2Cl�� ��4H+===2ClO2����Cl2����2H2O
��4��������ϵѹǿ������˫��ˮ�ֽ⣻H2O
��5��C
���������⣺��1����2��������Ŀ��֪��ˮԡ��ƿ�ڷ���2ClO2��H2O2��2NaOH===2NaClO2��O2����2H2O��H2O2�����ֽ⣬ClO2�е�ͣ������¶ȿ��Լ���˫��ˮ�ֽ⡢���ClO2���ܽ�ȵȴӶ���߲��ʣ���������������ǽ�ClO2��������������Һ��˫��ˮ�Ļ��Һ��Ӧ��������ClO2���ܼ�ʱ�����ߣ�Ũ�ȹ��ߵ��·ֽ⣬���죬ClO2���ܱ���ַ�Ӧ���ա���3��������ƿ���ܷ�Ӧ���ӷ���ʽ2ClO3����H2O2��2H+===2ClO2����O2����2H2O���ֲ���Ӧ����ȥ��H2O2��Cl2===2Cl����O2��2H+��Ӧ�����ɵâٷ�ӦΪ2ClO3�� ��2Cl�� ��4H+===2ClO2����Cl2����2H2O �����߸��ݷ���ȷ����Ӧ�ٵķ�Ӧ��ΪClO3�� ��Cl��������ΪClO2��Cl2 �� ���������غ㡢����غ㡢ԭ���غ���ƽ����ʽ����4��Ϊ��Ũ�����˫��ˮ��Һ��Ũ�ȣ���Ҫ��ȥ���е�һ����ˮ����������˫��ˮ�����ֽ⣬����ͨ����ѹ����������Խ���ˮ�ķе㣬�Ӷ���ֹ˫��ˮ�ֽ⣨5��ϴ��ʱϴ�Ӽ�Ӧ����ͨ�������ſɳ��ϴ��


 ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʮ�����ʣ���Һ̬�Ȼ����С�մ� �۹��崿�� �ܶ�����̼�������� ���������� �������������� �ఱˮ ����� ����������Һ
��1������ʮ�������У����ڵ���ʵ��� �� ���ڷǵ���ʵ��� ��
��2��������������ˮ��Һ�пɷ�����Ӧ�����ӷ���ʽΪ��H++OH��=H2O���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3����ȥ���������ڵIJ����� �� ��ѧ����ʽΪ ��
��4����״���£�L���к���0.4mol ��ԭ�ӣ�
��5������100mL����Һ�к�Fe3+5.6g������Һ��SO42�������ʵ���Ũ���� ��
��6�����ڢ��л�������ޣ������������� ��
��7�����ټ��뵽���У���ĵ��������仯Ϊ�����ǿ�������������������䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeSO4���ȷֽ�Ļ�ѧ����ʽΪ�� 2FeSO4Fe2O3��SO2����SO3��
��ش�
��1����FeSO4���Ȳ��������尴ͼʾװ�ý���ʵ�飬֤ʵ����SO3��SO2����˵��SO2���ڵ�ʵ����������Ϊ�ⶨBaSO4�����������������IJ�����������Ϊ��ϴ�ӡ�������ء�
��2�����һ��ʵ�鷽�����û�ѧ������֤FeSO4���Ⱥ����ijɷ�(������������Ӧ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ѡ���У������Ҳ�ʾ��ͼ��ʾ����
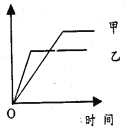
��Ӧ | ������ | �� | �� | |
A | ��ͬ����������ͬһ�����У�2NH3 | ������ת���� | 500�� | 400�� |
B | �������ļء��Ʒֱ���ˮ��Ӧ | H2������ | �� | �� |
C | �����Ϊ1�U3��N2��H2��������ɱ�ĺ�ѹ�������� N2��3H2 | ������Ũ�� | ���ԸߵĴ��� | ����һ��Ĵ��� |
D | 2mol SO2��1mol O2������ͬ�¶��£�2SO2��O2 | SO3�����ʵ��� | 10 MPa | 20 MPa |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������CO2�ֱ�ͨ����CaCl2��Һ����Na2SiO3��Һ����Ca��ClO��2��Һ����Ba��OH��2��Һ,�г����������� �� ��
A.�٢ڢۢ�B.�٢ڢ�C.�ڢۢ�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
��Ħ���Ρ��Ƿ�����ѧ�е���Ҫ�Լ�����ѧʽΪ(NH4)2Fe(SO4)2��6H2O����Ħ���Ρ���һ�������·ֽ�ķ���ʽΪ��4[(NH4)2Fe(SO4)2��6H2O] ![]() 2Fe2O3��3SO3��5SO2����N2����6NH3����31H2O���ش��������⣺
2Fe2O3��3SO3��5SO2����N2����6NH3����31H2O���ش��������⣺
��1����Ԫ����Ԫ�����ڱ��е�λ��Ϊ �� ��۲�����Ų�ͼΪ��
��2����ɡ�Ħ���Ρ��ķǽ���Ԫ���е�һ����������Ԫ��Ϊ����Ħ���Ρ��ķֽ���������ڷǼ��Է��ӵĻ���������
��3��NH3�ķе��N2O�ķе�����ߡ��͡���������Ҫԭ������
��4��K3[Fe(CN)6]�����ڼ���Fe2�� �� K3[Fe(CN)6]�г������Ӽ�������ڵĻ�ѧ��Ϊ �� ��CN����Ϊ�ȵ�����ĵ��ʵķ���ʽΪ_��HCN�����ЦҼ��ͦм��ĸ���֮��Ϊ��
��5��FeO�����ṹ����ͼ��ʾ��FeO������Fe2+��λ��Ϊ �� ���þ����߳�Ϊacm����þ����ܶ�Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״�����Т�6.72L CH4��3.01��1023��HCl��13.6g H2S��0.2mol NH3 �� ���ж���������Ĺ�ϵ��С�����ʾ����ȷ���ǣ� ��
A.����ܣ��٣��ۣ���
B.�ܶȢ٣��ܣ��ۣ���
C.�����ܣ��٣��ۣ���
D.��ԭ�����ܣ��ڣ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ǣ� ��
A. Ũ������̼��Ӧ���������ɫ����
B. �Թ��ڱ��ϸ��ŵ�����ö���̼ϴȥ
C. ��ҵ������N2��H2��Ӧ���е��Ĺ̶�
D. ʵ�����ü���NH4Cl����ķ�����ȡNH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ��2Ag��(aq)��Cu(s)=Cu2��(aq)��2Ag(s)��Ƶ�ԭ�����ͼ��ʾ����ش��������⣺

��1���缫X�IJ�����______���������ҺY��________��
��2�����缫Ϊ��ص�______���������ĵ缫��ӦʽΪ_______________��X�缫�Ϸ����ĵ缫��ӦʽΪ_________________��
��3����ͼΪֱ����Դ���ϡNa2SO4ˮ��Һ��װ�á�ͨ�����ʯī�缫a��b�����ֱ�μӼ���ʯ����Һ����缫aΪ���ص�_______����b�缫�������ֵ�����Ϊ______________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com