
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
��Ħ���Ρ��Ƿ�����ѧ�е���Ҫ�Լ�����ѧʽΪ(NH4)2Fe(SO4)2��6H2O����Ħ���Ρ���һ�������·ֽ�ķ���ʽΪ��4[(NH4)2Fe(SO4)2��6H2O] ![]() 2Fe2O3��3SO3��5SO2����N2����6NH3����31H2O���ش��������⣺
2Fe2O3��3SO3��5SO2����N2����6NH3����31H2O���ش��������⣺
��1����Ԫ����Ԫ�����ڱ��е�λ��Ϊ �� ��۲�����Ų�ͼΪ��
��2����ɡ�Ħ���Ρ��ķǽ���Ԫ���е�һ����������Ԫ��Ϊ����Ħ���Ρ��ķֽ���������ڷǼ��Է��ӵĻ���������
��3��NH3�ķе��N2O�ķе�����ߡ��͡���������Ҫԭ������
��4��K3[Fe(CN)6]�����ڼ���Fe2�� �� K3[Fe(CN)6]�г������Ӽ�������ڵĻ�ѧ��Ϊ �� ��CN����Ϊ�ȵ�����ĵ��ʵķ���ʽΪ_��HCN�����ЦҼ��ͦм��ĸ���֮��Ϊ��
��5��FeO�����ṹ����ͼ��ʾ��FeO������Fe2+��λ��Ϊ �� ���þ����߳�Ϊacm����þ����ܶ�Ϊ��
���𰸡�
��1���������ڵڢ��壻![]()
��2��N��SO3
��3���ߣ�NH3���Ӽ�������
��4�����ۼ�����λ����N2��1:1
��5��6��![]() g/cm3
g/cm3
���������⣺��1��)����ԭ��������26��λ�ڵ������ڵڢ���;���ݺ�������Ų����ɿ�֪���ļ۲�����Ų�ͼΪ ![]() ����2����ɡ�Ħ���Ρ��ķǽ���Ԫ����H��N��O��S�����е�һ����������Ԫ��ΪN������������ƽ�������νṹ�����ڷǼ��Է��ӡ���3��NH3���Ӽ������������NH3�ķе��N2O�ķе�ߡ���4��K3[Fe(CN)6]�����У�����Fe3���пչ�����ܽ��ܹ¶Ե��ӣ�CN-���ṩ�¶Ե��ӣ�����Fe3����CN-֮��Ļ�ѧ������Ϊ��λ��������C��N֮�仹�й��ۼ�;�ȵ�������ԭ������ȣ��۵�����Ҳ��ȵ����ӻ���ӣ���CN-��Ϊ�ȵ�����ĵ��ʵķ���ʽΪN2;(5)����������Ϊ���ģ���X��Y��Z��������и��֪����������λ��Ϊ
����2����ɡ�Ħ���Ρ��ķǽ���Ԫ����H��N��O��S�����е�һ����������Ԫ��ΪN������������ƽ�������νṹ�����ڷǼ��Է��ӡ���3��NH3���Ӽ������������NH3�ķе��N2O�ķе�ߡ���4��K3[Fe(CN)6]�����У�����Fe3���пչ�����ܽ��ܹ¶Ե��ӣ�CN-���ṩ�¶Ե��ӣ�����Fe3����CN-֮��Ļ�ѧ������Ϊ��λ��������C��N֮�仹�й��ۼ�;�ȵ�������ԭ������ȣ��۵�����Ҳ��ȵ����ӻ���ӣ���CN-��Ϊ�ȵ�����ĵ��ʵķ���ʽΪN2;(5)����������Ϊ���ģ���X��Y��Z��������и��֪����������λ��Ϊ ![]() =6;��ͼ��֪���þ������������Ӹ���
=6;��ͼ��֪���þ������������Ӹ��� ![]() �������Ӹ���=1+12
�������Ӹ���=1+12 ![]() =4��,�辧���߳�Ϊacm���������Ϊa3cm3,��p=
=4��,�辧���߳�Ϊacm���������Ϊa3cm3,��p= 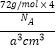 =
= ![]() g/cm3��
g/cm3��


 �㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
�㽭֮�ǿ�ʱ�Ż���ҵϵ�д� ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���ֽ��ʹ�ü�ʵ�������������ȷ����
A.��ʪ���pH��ֽ�ⶨ��Һ��pH������pHһ����
B.ʹʪ��ĵ��۵⻯����ֽ����������һ��������
C.ʹʪ��ĺ�ɫʯ����ֽ��ɫ�������Ȼ��SO2
D.��ʪ��ĺ�ɫʯ����ֽ����NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״����VL�����ܽ���1Lˮ�У�ˮ���ܶȽ���Ϊ1g/ml����������Һ���ܶ�Ϊ�� g/ml����������Ϊw������Ũ��Ϊcmol/L�������й�ϵ�в���ȷ���ǣ� ��
A.��= ![]()
B.W= ![]()
C.W= ![]()
D.C= ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ��Һ�л����ص���NaOH��Һֱ���������������������������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ���ɴ�ȷ����ԭ��Һ�к��е����ӿ����ǣ� �� 
A.Mg2+��Al3+��Fe3+
B.H+��Mg2+��Al3+
C.H+��Ba2+��Al3+
D.Na+��Mg2+��Al3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⡿ClO2��һ����������������Ũ�ȹ���ʱ�����ֽ⣬�������Ƴ�NaClO2���壬�Ա���������档�������ⷨ�Ʊ�NaClO2�����ʵ��װ����ͼ1��ʾ��
��֪��2NaClO3��H2O2��H2SO4===2ClO2����O2����Na2SO4��2H2O
2ClO2��H2O2��2NaOH===2NaClO2��O2����2H2O
ClO2�۵㣭59�桢�е�11�棻H2O2�е�150��
��ش�
��1������A������������ˮԡ��ȴ��Ŀ����(д����)��
��2���������ٹ���������������NaClO2���ʣ��Խ�����ԭ����
��3��Cl������ʱ���ClO2�����ɡ���Ӧ��ʼʱ��������ƿ�м����������ᣬClO2���������ʴ����ߣ����������������ù��̿��ܾ�������Ӧ��ɣ����䲹����������(�����ӷ���ʽ��ʾ)����H2O2��Cl2===2Cl����O2��2H+��
��4��H2O2Ũ�ȶԷ�Ӧ������Ӱ�졣ͨ��ͼ2��ʾװ�ý�����30% H2O2��ҺŨ����40%��B��Ӧ����һ���豸�����豸�������� �� ���������
��5�����˷�����NaClO2�����У����в�������ȷ���ǣ���������
A.Ϊ��ֹ��ֽ����ʴ���ò�����ά������ֽ���г���
B.��ת����Һ��©��������Һ������ʱ��ת�Ƴ���
C.ϴ�ӳ���ʱ��Ӧʹϴ�Ӽ�����ͨ������
D.������ϣ��Ͽ�ˮ��������ƿ�����Ƥ�ܺر�ˮ��ͷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�����ܽ�Al��OH��3 �� �����ܽ�H2SiO3 �� �ڸ���Һ�п��Դ���������������ǣ� ��
A.K+��Na+��HCO ![]() ��NO
��NO ![]()
B.Na+��SO ![]() ��Cl����ClO��
��Cl����ClO��
C.H+��Mg2+��SO ![]() ��NO
��NO ![]()
D.Ag+��K+��NO ![]() ��Na+
��Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ijҩ����п��������ã��Ʊ���ҩ������һ����ӦΪ�� 
����˵������ȷ���ǣ� ��
A.a�вμӷ�Ӧ�Ĺ��������Ȼ�
B.������b����ȼ�Ϻ��ܼ�
C.c��������ˮ
D.�÷�Ӧ����Ϊȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijƷ������Ƭ��Ѫ������ȥ���º��Ե�����ɫ����Ҫ�ɷ������������������������Ļ����ij�о���ѧϰС��Ϊ�ⶨ�ò�Ѫ�������������ĺ�������������̽����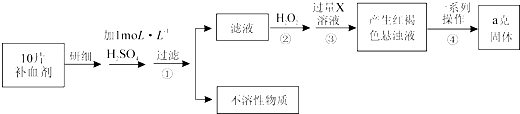
��ش��������⣺
��1����ʵ��ʱ��10molL��1��Ũ���ᣬ����100mL 1molL��1 H2SO4��Һ������Ũ��������ΪmL�������в����У�����ƿ���߱��Ĺ����У�����ţ���
A������һ�����ȷŨ�ȵı���Һ B������������Һ
C��������������Ͳ��ȡһ�������Һ�� D�������ܽ��������
�����������ƹ���ʾ��ͼ�У��д����������д��ţ���
������˵����ȷ��
A��ϴ���ձ�2��3�Σ�����ϴ��Һ��������ƿ�Լ������
B��ijͬѧ��Ũ����ϡ�ͺ�δ��ȴ�����±㽫��Һת��������ƿ��������ҺŨ�Ȼ�ƫ��
C������ʱ���ӹ۲죬������ҺŨ�Ȼ�ƫ��
��2���ٲ���ڼ������H2O2����Һ����Ҫ���ڵĽ��������������ڴӺ��ɫ������Һ�����ij����������������Ļ�������Ϊ��a�� �� b��ϴ�ӣ�c�����գ�d����ȴ
�����Ƶù��������Ϊag����ÿƬ��Ѫ���к���������������Ϊg��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com