
【题目】已知某药物具有抗痉挛作用,制备该药物其中一步反应为: 
下列说法不正确的是( )
A.a中参加反应的官能团是羧基
B.生活中b可作燃料和溶剂
C.c极易溶于水
D.该反应类型为取代反应
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛( ![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛( ![]() )。下列说法错误的是( )
)。下列说法错误的是( )
A.肉桂醛能发生加成反应、取代反应和加聚反应
B.可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C.肉桂醛和苯甲醛互为同系物
D.苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
“摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
(1)铁元素在元素周期表中的位置为 , 其价层电子排布图为。
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为。“摩尔盐”的分解产物中属于非极性分子的化合物是。
(3)NH3的沸点比N2O的沸点(填“高”或“低”),其主要原因是。
(4)K3[Fe(CN)6]常用于检验Fe2+ , K3[Fe(CN)6]中除了离子键以外还存在的化学键为 , 与CN—互为等电子体的单质的分子式为_。HCN分子中σ键和π键的个数之比为。
(5)FeO晶胞结构如下图所示,FeO晶体中Fe2+配位数为 , 若该晶胞边长为acm,则该晶胞密度为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域应用广泛.下图是利用乙酰丙酸(α)合成聚芳酯E的路线(省略部分产物): 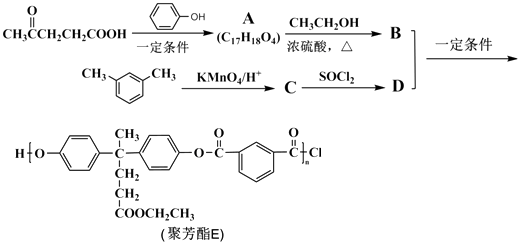
已知: ![]() +R′OH→
+R′OH→ ![]() +HCl
+HCl![]()
(R、R′表示烃基)
(1)A中含有的官能团是(填官能团名称).
(2)B与D的反应类型为 , B的结构简式为 .
(3)C生成D的反应化学方程式为 .
(4)C分子的核磁共振氢谱中有个吸收峰;同时符合下列要求的C的同分异构体有种.①能发生银镜反应 ②能与NaHCO3溶液反应 ③遇FeCl3溶液显紫色, F与C属于官能团异构的同分异构体,且只含一种官能团,则1mol F与足量NaOH溶液反应时消耗NaOH的物质的量为 .
(5)根据合成聚芳酯E的路线,请你以苯酚及2﹣丙醇为原料(无机试剂任选),设计合成G: ![]() 的路线. .
的路线. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 浓硝酸与碳反应会产生红棕色气体
B. 试管内壁上附着的硫可用二硫化碳洗去
C. 工业上利用N2与H2反应进行氮的固定
D. 实验室用加热NH4Cl晶体的方法制取NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于二氧化硅的说法中,错误的是
A. 二氧化硅和二氧化碳在物理性质上有很大的差别
B. 二氧化硅分子由一个硅原子和两个氧原子构成
C. 工业上用二氧化硅制粗硅
D. 二氧化硅既能与氢氟酸反应,又能与烧碱反应,但它不是两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如图1所示. 
(1)为提高锌灰的浸取率,可采用的方法是(填序号).
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是(写化学式).
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S.
①检验ZnS固体是否洗涤干净的方法是 ,
②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取.化学反应方程式为
③已知Na2SO4 . 10H2O及Na2SO4的溶解度随温度变化曲线如图2.从滤液中得到Na2SO4.10H2O的操作方法是
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL,物质的量浓度为c mol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)一种高效氯化剂、漂白剂,在NaOH溶液中ClO2与H2O2反应可以得到亚氯酸钠.
(1)ClO2中氯元素的化合价是;在制备亚氯酸钠的反应中ClO2做(填“氧化剂”或“还原剂”);若反应中生成1molNaClO2 , 转移电子物质的量为mol;
(2)写出该反应的化学方程式为;
(3)科学家经研究发现NaClO2也可用于制取自来水消毒剂ClO2 . 2NaClO2+Cl2═2ClO2+2NaCl,还原产物为 , 用单线桥法标出电子转移的方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌.以下是用过氧化氢法生产亚氯酸钠的工艺流程图: 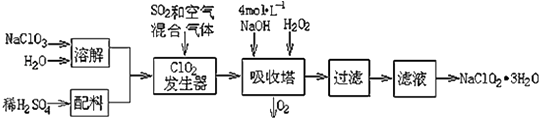
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O;
②Ksp(FeS)=6.3×10﹣18; Ksp(CuS)=6.3×10﹣36;Ksp(PbS)=2.4×10﹣28
(1)吸收塔内发生反应的离子方程式为 . 该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2 . 若用二氧化氯和浓盐酸制取Cl2 , 当生成5mol Cl2时,通过还原反应制得氯气的质量为g.
(2)从滤液中得到NaClO23H2O晶体的所需操作依次是(填写序号). a.蒸馏 b.灼烧 c.过滤 d.冷却结晶 e.蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2 . 表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | HCN | H2S |
Ka | 1×10﹣2 | 6.3×10﹣4 | 4.9×10﹣10 | K1=9.1×10﹣8 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为(用化学式表示);体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:(填“前者大”“相等”或“后者大”).
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是;当最后一种离子沉淀完全时(该离子浓度为10﹣5molL﹣1),此时体系中的S2﹣的浓度为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com