
����Ŀ���������ƣ�NaClO2��һ�ָ�Ч�Ȼ�����Ư������NaOH��Һ��ClO2��H2O2��Ӧ���Եõ��������ƣ�
��1��ClO2����Ԫ�صĻ��ϼ��������Ʊ��������Ƶķ�Ӧ��ClO2���������������ԭ������������Ӧ������1molNaClO2 �� ת�Ƶ������ʵ���Ϊmol��
��2��д���÷�Ӧ�Ļ�ѧ����ʽΪ��
��3����ѧ�Ҿ��о�����NaClO2Ҳ��������ȡ����ˮ������ClO2 �� 2NaClO2+Cl2�T2ClO2+2NaCl����ԭ����Ϊ �� �õ����ŷ��������ת�Ƶķ������Ŀ ��
���𰸡�
��1��+4����������1
��2��2ClO2+H2O2+2NaOH�T2NaClO2+O2��+2H2O
��3��NaCl��
���������⣺��1��ClO2��OԪ�ػ��ϼ�Ϊ��2�ۣ����ݻ������и�Ԫ�ػ��ϼ۴�����Ϊ0ȷ��ClԪ�ػ��ϼ�Ϊ+4�ۣ��õ��ӻ��ϼ۽��͵ķ�Ӧ������������ʧ���ӻ��ϼ����ߵķ�Ӧ���ǻ�ԭ��������ClO2����������˫��ˮ�ǻ�ԭ�����÷�Ӧ��ClԪ�ػ��ϼ���+4�۱�Ϊ+3�ۣ�����1molNaClO2�Ƶ���1mol�����Դ��ǣ�+4����������1����2���������Ⱥ�˫��ˮ���������Ʒ�Ӧ����NaClO2��������ˮ����Ӧ����ʽΪ2ClO2+H2O2+2NaOH�T2NaClO2+O2��+2H2O�����Դ��ǣ�2ClO2+H2O2+2NaOH�T2NaClO2+O2��+2H2O����3���÷�Ӧ��ClԪ�ػ��ϼ���+3�ۡ�0�۱�Ϊ+4�ۡ���1�ۣ�����������������Ӧ�IJ������Ȼ��ƣ�Cl2����NaClO2��Һ��ȡClO2 �� ��������ԭΪ�����ӣ�1���������ӷ�Ӧ�õ�2�����ӣ�������ӷ���ʽ������ת�Ƶķ������Ŀ��ʾΪ  �����Դ��ǣ�NaCl��
�����Դ��ǣ�NaCl��  ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ��Һ�л����ص���NaOH��Һֱ���������������������������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ���ɴ�ȷ����ԭ��Һ�к��е����ӿ����ǣ� �� 
A.Mg2+��Al3+��Fe3+
B.H+��Mg2+��Al3+
C.H+��Ba2+��Al3+
D.Na+��Mg2+��Al3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ijҩ����п��������ã��Ʊ���ҩ������һ����ӦΪ�� 
����˵������ȷ���ǣ� ��
A.a�вμӷ�Ӧ�Ĺ��������Ȼ�
B.������b����ȼ�Ϻ��ܼ�
C.c��������ˮ
D.�÷�Ӧ����Ϊȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к�����Fe2+��Al3+��Fe3+��Na+��Cl����SO ![]() ���ӣ����м���������Na2O2������ټ��������������ܽ�����������Һ�е�������Ŀ�뷴Ӧǰ��ȱ��ֲ�����ǣ� ��
���ӣ����м���������Na2O2������ټ��������������ܽ�����������Һ�е�������Ŀ�뷴Ӧǰ��ȱ��ֲ�����ǣ� ��
A.Na+��Fe2+
B.Al3+��SO ![]()
C.Fe3+��SO ![]()
D.Al3+��Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ1.00L�������У�ͨ��һ������N2O4��������ӦN2O4(g) ![]() 2NO2(g)�����¶����ߣ�����������ɫ���
2NO2(g)�����¶����ߣ�����������ɫ���
��1����Ӧ����H________0����������������С��������100 ��ʱ����ϵ�и�����Ũ����ʱ��仯��ͼ��ʾ����0��60 sʱ�Σ���Ӧ����v(N2O4)Ϊ________mol��L-1��s-1����Ӧ��ƽ�ⳣ��K1Ϊ_____________��

��2��100 ��ʱ�ﵽƽ��ı䷴Ӧ�¶�ΪT��c(N2O4)��0.0020 mol��L-1��s-1��ƽ�����ʽ��ͣ���10 s�ִﵽƽ�⡣T______100 ������������������С���������ж�������____________________________________________��
��3���¶�Tʱ��Ӧ��ƽ�����Ӧ�������ݻ�����һ�룬ƽ����________����������Ӧ�������淴Ӧ���������ƶ����ж�������____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£��������м��ַ�Ӧ����16H++10Zһ+2XO ![]() =2X2++5Z2+8H2O ��2A2++B2=2A3++2Bһ ��2Bһ+Z2=B2+2Z����������Ӧ���ж����н����д�����ǣ� ��
=2X2++5Z2+8H2O ��2A2++B2=2A3++2Bһ ��2Bһ+Z2=B2+2Z����������Ӧ���ж����н����д�����ǣ� ��
A.������ǿ����˳��Ϊ��XO ![]() ��Z2��B2��A3+
��Z2��B2��A3+
B.Z2�ڢ١��۷�Ӧ��Ϊ��ԭ��
C.��Һ�пɷ�����Z2+2A2+=2A3++2Zһ
D.X2ʮ��XO ![]() ����������
����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijƷ������Ƭ��Ѫ������ȥ���º��Ե�����ɫ����Ҫ�ɷ������������������������Ļ����ij�о���ѧϰС��Ϊ�ⶨ�ò�Ѫ�������������ĺ�������������̽����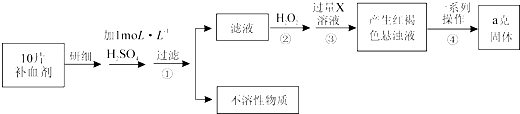
��ش��������⣺
��1����ʵ��ʱ��10molL��1��Ũ���ᣬ����100mL 1molL��1 H2SO4��Һ������Ũ��������ΪmL�������в����У�����ƿ���߱��Ĺ����У�����ţ���
A������һ�����ȷŨ�ȵı���Һ B������������Һ
C��������������Ͳ��ȡһ�������Һ�� D�������ܽ��������
�����������ƹ���ʾ��ͼ�У��д����������д��ţ���
������˵����ȷ��
A��ϴ���ձ�2��3�Σ�����ϴ��Һ��������ƿ�Լ������
B��ijͬѧ��Ũ����ϡ�ͺ�δ��ȴ�����±㽫��Һת��������ƿ��������ҺŨ�Ȼ�ƫ��
C������ʱ���ӹ۲죬������ҺŨ�Ȼ�ƫ��
��2���ٲ���ڼ������H2O2����Һ����Ҫ���ڵĽ��������������ڴӺ��ɫ������Һ�����ij����������������Ļ�������Ϊ��a�� �� b��ϴ�ӣ�c�����գ�d����ȴ
�����Ƶù��������Ϊag����ÿƬ��Ѫ���к���������������Ϊg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2ֱ���ŷŻ�Ի������Σ����SO2��β������ͨ�������¼��ַ����� 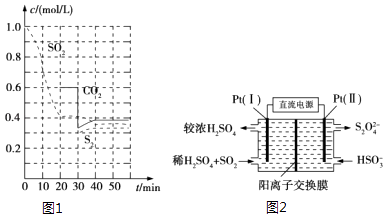
��1������̿��ԭ�� ��Ӧԭ�������º���ʱ2C��s��+2SO2��g��S2��g��+2CO2��g����
��Ӧ���е���ͬʱ���ø����ʵ�Ũ����ͼ1��
��0��20min��Ӧ���ʱ�ʾΪv��SO2��=��
��30minʱ���ı�ijһ����ƽ�ⷢ���ƶ�����ı���������п�������
����˵��������Ӧ�ﵽƽ��״̬���� ��
a��SO2 ������������CO2 ������������ͬ b�����������ܶȲ���
c��S2��Ũ�Ȳ��� d��SO2 ��S2�����ʵ���֮��Ϊ2��1
��2�������������շ� ��Na2SO3��Һ����SO2�����ӷ���ʽΪ��
�ڳ����£���������NaHSO3ʱ������Һ���������Ũ�ȹ�ϵһ����ȷ����������ţ���
a��c��Na+��+c��H+����c��SO32����+c��HSO3����+c��OH����
b��c��Na+��=c��SO32����+c��HSO3����+c��H2SO3��
c��c��Na+����c��HSO3������c��H+����c��SO32����
d��ˮ�����c��H+��=1��10��8 mol/L
��3���绯ѧ������ ����ͼ2��ʾ��Pt���缫�ĵ缫��ӦʽΪ��
�ڵ���·��ת��0.02mol e��ʱ����ŨH2SO4��δ�ų���������Ĥ�����Һ��Լ����mol���ӣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ã���X,Yѡ�ò�ͬ����ʱ���ɽ����ԭ���㷺Ӧ���ڹ�ҵ����������˵������ȷ���ǣ� �� 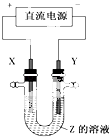
A.�ȼҵ�У�X,Y��Ϊʯī��X�����ܵõ���������
B.ͭ�ľ����У�X�Ǵ�ͭ��Y�Ǵ�ͭ��Z��CuSO4
C.��ƹ�ҵ�У�X�Ǵ��ƽ�����Y�ǶƲ����
D.��ӵ����������������У�Y�Ǵ���������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com