
【题目】某溶液中含大量Fe2+、Al3+、Fe3+、Na+、Cl﹣、SO ![]() 离子,其中加入足量的Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是( )
离子,其中加入足量的Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是( )
A.Na+、Fe2+
B.Al3+、SO ![]()
C.Fe3+、SO ![]()
D.Al3+、Cl﹣
【答案】B
【解析】解:A、因为Na2O2是强氧化剂,而且遇水生成NaOH,钠离子浓度增大,故A错误;B、Na2O2是强氧化剂,而且遇水生成NaOH,铝离子能和过量的氢氧化钠反应生成四羟基合铝酸根离子,在盐酸作用下又会生成铝离子,根据铝元素守恒,则铝离子量不变,硫酸根离子自始至终不发生变化,故B正确;
C、因为Na2O2是强氧化剂,而且遇水生成NaOH,于是Fe2+氧化成Fe3+ , 并沉淀,再和盐酸反应生成三价铁离子,所以三价铁离子浓度增大,故C错误;
D、加入足量的盐酸溶解沉淀,氯离子浓度增大,故D错误.
故选B.
溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,Fe2+氧化成Fe3+ , 减少的是亚铁离子,增加的是三价铁离子、钠离子、氯离子,铝离子、硫酸根离子保持不变.


科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,下列关于试管中的现象描述不正确的是( )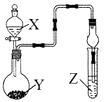
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
A | 稀硫酸 | Na2O2 | 氢硫酸 | 产生淡黄色沉淀 |
B | 浓氨水 | 碱石灰 | 氯化铝溶液 | 产生白色沉淀 |
C | 浓硝酸 | Cu | 硅酸钠溶液 | 产生白色沉淀 |
D | 稀盐酸 | CaCO3 | 氯化钡溶液 | 产生白色沉淀 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域应用广泛.下图是利用乙酰丙酸(α)合成聚芳酯E的路线(省略部分产物): 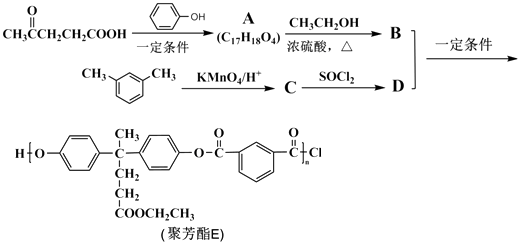
已知: ![]() +R′OH→
+R′OH→ ![]() +HCl
+HCl![]()
(R、R′表示烃基)
(1)A中含有的官能团是(填官能团名称).
(2)B与D的反应类型为 , B的结构简式为 .
(3)C生成D的反应化学方程式为 .
(4)C分子的核磁共振氢谱中有个吸收峰;同时符合下列要求的C的同分异构体有种.①能发生银镜反应 ②能与NaHCO3溶液反应 ③遇FeCl3溶液显紫色, F与C属于官能团异构的同分异构体,且只含一种官能团,则1mol F与足量NaOH溶液反应时消耗NaOH的物质的量为 .
(5)根据合成聚芳酯E的路线,请你以苯酚及2﹣丙醇为原料(无机试剂任选),设计合成G: ![]() 的路线. .
的路线. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于二氧化硅的说法中,错误的是
A. 二氧化硅和二氧化碳在物理性质上有很大的差别
B. 二氧化硅分子由一个硅原子和两个氧原子构成
C. 工业上用二氧化硅制粗硅
D. 二氧化硅既能与氢氟酸反应,又能与烧碱反应,但它不是两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如图1所示. 
(1)为提高锌灰的浸取率,可采用的方法是(填序号).
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是(写化学式).
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S.
①检验ZnS固体是否洗涤干净的方法是 ,
②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取.化学反应方程式为
③已知Na2SO4 . 10H2O及Na2SO4的溶解度随温度变化曲线如图2.从滤液中得到Na2SO4.10H2O的操作方法是
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL,物质的量浓度为c mol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH﹣数目为0.2NA
B.﹣定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA
C.将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D.4.6g乙醇含有共价键的数目为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)一种高效氯化剂、漂白剂,在NaOH溶液中ClO2与H2O2反应可以得到亚氯酸钠.
(1)ClO2中氯元素的化合价是;在制备亚氯酸钠的反应中ClO2做(填“氧化剂”或“还原剂”);若反应中生成1molNaClO2 , 转移电子物质的量为mol;
(2)写出该反应的化学方程式为;
(3)科学家经研究发现NaClO2也可用于制取自来水消毒剂ClO2 . 2NaClO2+Cl2═2ClO2+2NaCl,还原产物为 , 用单线桥法标出电子转移的方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C10H12O2的有机物,满足以下条件:①苯环上只有两个取代基;②与FeCl3溶液发生显色反应;③能发生银镜反应.则满足这些条件的有机物共有( )
A.6种
B.9种
C.12种
D.15种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法中正确的是( )
A.陶瓷、玻璃、水泥容器都能贮存氢氟酸
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞的试剂瓶中
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2 ![]() CO2+Na2SiO3可知硅酸的酸性大于碳酸
CO2+Na2SiO3可知硅酸的酸性大于碳酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com