
【题目】聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域应用广泛.下图是利用乙酰丙酸(α)合成聚芳酯E的路线(省略部分产物): 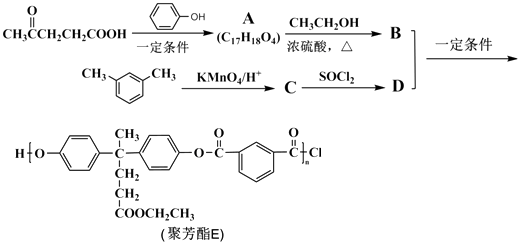
已知: ![]() +R′OH→
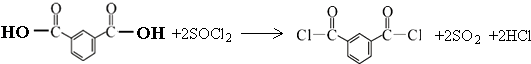
+R′OH→ ![]() +HCl
+HCl![]()
(R、R′表示烃基)
(1)A中含有的官能团是(填官能团名称).
(2)B与D的反应类型为 , B的结构简式为 .
(3)C生成D的反应化学方程式为 .
(4)C分子的核磁共振氢谱中有个吸收峰;同时符合下列要求的C的同分异构体有种.①能发生银镜反应 ②能与NaHCO3溶液反应 ③遇FeCl3溶液显紫色, F与C属于官能团异构的同分异构体,且只含一种官能团,则1mol F与足量NaOH溶液反应时消耗NaOH的物质的量为 .
(5)根据合成聚芳酯E的路线,请你以苯酚及2﹣丙醇为原料(无机试剂任选),设计合成G: ![]() 的路线. .
的路线. .
【答案】
(1)羧基、羟基
(2)缩聚反应;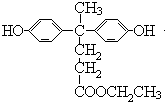
(3)
(4)4;10;4mol
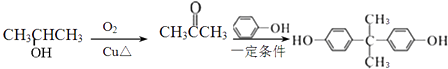
(5)
【解析】解: 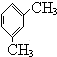 被酸性高锰酸钾氧化生成C为
被酸性高锰酸钾氧化生成C为 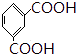 ,C中羧基上的羟基被氯原子取代生成D为
,C中羧基上的羟基被氯原子取代生成D为 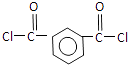 ,由聚芳酯E的结构可知B为
,由聚芳酯E的结构可知B为 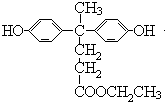 ,逆推可知A为
,逆推可知A为 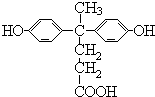 .(1.)A为
.(1.)A为 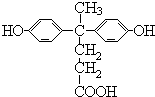 ,含有的官能团是:羧基、羟基,所以答案是:羧基、羟基;
,含有的官能团是:羧基、羟基,所以答案是:羧基、羟基;
(2.)B与D发生缩聚反应生成聚芳酯(PAR),B的结构简式为 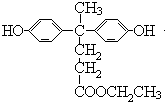 ,
,
所以答案是:缩聚反应;  ;
;
(3.)C生成D的反应化学方程式为:  ,
,
所以答案是:  ;
;
(4.)C的结构简式为  ,核磁共振氢谱中有4个吸收峰,同时符合下列要求的C的同分异构体:①能发生银镜反应,说明含有醛基,②能与NaHCO3溶液反应,说明含有羧基,③遇FeCl3溶液显紫色,说明含有酚羟基,则取代基为﹣OH、﹣COOH、﹣CHO,当﹣OH、﹣COOH处于邻位时,﹣CHO有4种位置,当﹣OH、﹣COOH处于间位时,﹣CHO有4种位置,当﹣OH、﹣COOH处于对位时,﹣CHO有2种位置,共有10种,
,核磁共振氢谱中有4个吸收峰,同时符合下列要求的C的同分异构体:①能发生银镜反应,说明含有醛基,②能与NaHCO3溶液反应,说明含有羧基,③遇FeCl3溶液显紫色,说明含有酚羟基,则取代基为﹣OH、﹣COOH、﹣CHO,当﹣OH、﹣COOH处于邻位时,﹣CHO有4种位置,当﹣OH、﹣COOH处于间位时,﹣CHO有4种位置,当﹣OH、﹣COOH处于对位时,﹣CHO有2种位置,共有10种,
F与C属于官能团异构的同分异构体,且只含一种官能团,则F为含有2个﹣OOCH,水解得到2mol羧基、2mol酚羟基,则1mol F与足量NaOH溶液反应时消耗NaOH的物质的量为4mol,
所以答案是:4;10;4mol;
(5.)结合转化关系中乙酰丙酸与苯酚转化为A的反应,可知2﹣丙醇氧化生成 ![]() ,丙酮与苯酚反应得到
,丙酮与苯酚反应得到 ![]() ,合成路线流程图为:
,合成路线流程图为:  ,
,
所以答案是:  .
.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】某种药物合成中间体的结构简式如图,有关该物质的说法不正确的是( ) 
A.属于芳香族化合物
B.能发生消去反应和酯化反应
C.能分别与金属Na、NaHCO3溶液反应
D.1mol该有机物与足量NaOH溶液反应,消耗5mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( ) 
A.Mg2+、Al3+、Fe3+
B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+
D.Na+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液既能溶解Al(OH)3 , 又能溶解H2SiO3 , 在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO ![]() 、NO
、NO ![]()
B.Na+、SO ![]() 、Cl﹣、ClO﹣
、Cl﹣、ClO﹣
C.H+、Mg2+、SO ![]() 、NO
、NO ![]()
D.Ag+、K+、NO ![]() 、Na+
、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某药物具有抗痉挛作用,制备该药物其中一步反应为: 
下列说法不正确的是( )
A.a中参加反应的官能团是羧基
B.生活中b可作燃料和溶剂
C.c极易溶于水
D.该反应类型为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含大量Fe2+、Al3+、Fe3+、Na+、Cl﹣、SO ![]() 离子,其中加入足量的Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是( )
离子,其中加入足量的Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是( )
A.Na+、Fe2+
B.Al3+、SO ![]()
C.Fe3+、SO ![]()
D.Al3+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法: 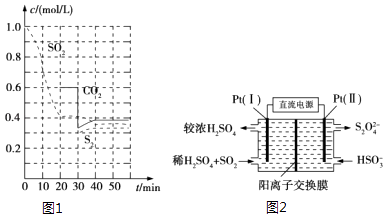
(1)活性炭还原法 反应原理:恒温恒容时2C(s)+2SO2(g)S2(g)+2CO2(g).
反应进行到不同时间测得各物质的浓度如图1:
①0~20min反应速率表示为v(SO2)=;
②30min时,改变某一条件平衡发生移动,则改变的条件最有可能是;
③能说明上述反应达到平衡状态的是 .
a.SO2 的消耗速率与CO2 的生成速率相同 b.混合气体的密度不变
c.S2的浓度不变 d.SO2 与S2的物质的量之比为2:1
(2)亚硫酸钠吸收法 ①Na2SO3溶液吸收SO2的离子方程式为;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是(填序号).
a.c(Na+)+c(H+)>c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
b.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
c.c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)
d.水电离出c(H+)=1×10﹣8 mol/L
(3)电化学处理法 ①如图2所示,Pt(Ⅰ)电极的电极反应式为;
②当电路中转移0.02mol e﹣时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加mol离子.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com