
【题目】SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法: 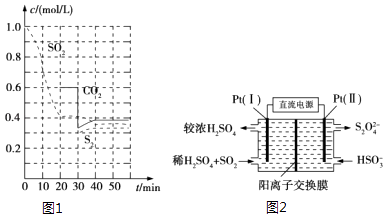
(1)活性炭还原法 反应原理:恒温恒容时2C(s)+2SO2(g)S2(g)+2CO2(g).
反应进行到不同时间测得各物质的浓度如图1:
①0~20min反应速率表示为v(SO2)=;
②30min时,改变某一条件平衡发生移动,则改变的条件最有可能是;
③能说明上述反应达到平衡状态的是 .
a.SO2 的消耗速率与CO2 的生成速率相同 b.混合气体的密度不变
c.S2的浓度不变 d.SO2 与S2的物质的量之比为2:1
(2)亚硫酸钠吸收法 ①Na2SO3溶液吸收SO2的离子方程式为;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是(填序号).
a.c(Na+)+c(H+)>c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
b.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
c.c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)
d.水电离出c(H+)=1×10﹣8 mol/L
(3)电化学处理法 ①如图2所示,Pt(Ⅰ)电极的电极反应式为;
②当电路中转移0.02mol e﹣时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加mol离子.
【答案】
(1)0.03mol/(L?min);减少CO2的浓度;bc
(2)SO32﹣+SO2+H2O=2HSO3﹣;abc
(3)SO2﹣2e﹣+2H2O=SO42﹣+4H+;0.03
【解析】解:(1.)①由图可知,0﹣20min内二氧化硫浓度变化量为1mol/L﹣0.4mol/L=0.6mol/L,故v(SO2)= ![]() =0.03mol/(Lmin), 所以答案是:0.03mol/(Lmin);②30min时瞬间,二氧化碳浓度降低,S2的浓度不变,而后二氧化碳、S2的浓度均增大,应是减少CO2的浓度,
=0.03mol/(Lmin), 所以答案是:0.03mol/(Lmin);②30min时瞬间,二氧化碳浓度降低,S2的浓度不变,而后二氧化碳、S2的浓度均增大,应是减少CO2的浓度,
所以答案是:减少CO2的浓度;③2C(s)+2SO2(g)S2(g)+2CO2(g)
a.SO2 的消耗速率与CO2 的生成速率相同,只能说明反应正向进行,不能说明反应达到平衡状态,故a错误;
b.反应前后气体质量变化,体积不变,混合气体的密度不变说明反应达到平衡状态,故b正确;
c.S2的浓度不变是平衡标志,故c正确;
d.SO2 与S2的物质的量之比为2:1不能说明反应达到平衡状态,故d错误;
所以答案是:bc;
(2.)①Na2SO3溶液与SO2反应生成亚硫酸氢钠,反应离子方程式为:SO32﹣+SO2+H2O=2HSO3﹣ ,
所以答案是:SO32﹣+SO2+H2O=2HSO3﹣;
②a.根据电荷守恒:c(Na+)+c(H+)=2c(SO32﹣)+c(HSO3﹣)+c(OH﹣),故溶液中c(Na+)+c(H+)>c(SO32﹣)+c(HSO3﹣)+c(OH﹣),故a正确;
b.溶液中S元素以SO32﹣、HSO3﹣、H2SO3形式存在,Na元素与硫元素物质的量之比为1:1,故溶液中c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO4),故b正确;
c.NaHSO3溶液中HSO3﹣的电离程度大于其水解程度,故溶液中c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣),故c正确;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度,故d错误,
所以答案是:abc;
(3.)①由图可知,Pt(1)电极上二氧化硫被氧化生成硫酸,电极反应式为:SO2﹣2e﹣+2H2O=SO42﹣+4H+ ,
所以答案是:SO2﹣2e﹣+2H2O=SO42﹣+4H+;
②左侧电极反应式为:SO2﹣2e﹣+2H2O=SO42﹣+4 H+ , 根据电子转移守恒,生成硫酸根物质的量 ![]() =0.01mol,生成氢离子为0.04mol,为保持溶液电中性,0.01mol硫酸根需要0.02mol氢离子,多余的氢离子通过阳离子交换膜移至右侧,即有0.02mol氢离子移至右侧,故左侧溶液中增加离子为0.01mol+0.02mol=0.03mol,
=0.01mol,生成氢离子为0.04mol,为保持溶液电中性,0.01mol硫酸根需要0.02mol氢离子,多余的氢离子通过阳离子交换膜移至右侧,即有0.02mol氢离子移至右侧,故左侧溶液中增加离子为0.01mol+0.02mol=0.03mol,
所以答案是:0.03.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域应用广泛.下图是利用乙酰丙酸(α)合成聚芳酯E的路线(省略部分产物): 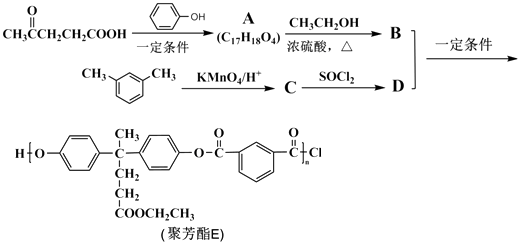
已知: ![]() +R′OH→
+R′OH→ ![]() +HCl
+HCl![]()
(R、R′表示烃基)
(1)A中含有的官能团是(填官能团名称).
(2)B与D的反应类型为 , B的结构简式为 .
(3)C生成D的反应化学方程式为 .
(4)C分子的核磁共振氢谱中有个吸收峰;同时符合下列要求的C的同分异构体有种.①能发生银镜反应 ②能与NaHCO3溶液反应 ③遇FeCl3溶液显紫色, F与C属于官能团异构的同分异构体,且只含一种官能团,则1mol F与足量NaOH溶液反应时消耗NaOH的物质的量为 .
(5)根据合成聚芳酯E的路线,请你以苯酚及2﹣丙醇为原料(无机试剂任选),设计合成G: ![]() 的路线. .
的路线. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)一种高效氯化剂、漂白剂,在NaOH溶液中ClO2与H2O2反应可以得到亚氯酸钠.
(1)ClO2中氯元素的化合价是;在制备亚氯酸钠的反应中ClO2做(填“氧化剂”或“还原剂”);若反应中生成1molNaClO2 , 转移电子物质的量为mol;
(2)写出该反应的化学方程式为;
(3)科学家经研究发现NaClO2也可用于制取自来水消毒剂ClO2 . 2NaClO2+Cl2═2ClO2+2NaCl,还原产物为 , 用单线桥法标出电子转移的方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C10H12O2的有机物,满足以下条件:①苯环上只有两个取代基;②与FeCl3溶液发生显色反应;③能发生银镜反应.则满足这些条件的有机物共有( )
A.6种
B.9种
C.12种
D.15种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组探究工业废Cu粉(杂质可能含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO45H2O,实现废物综合利用.他们进行了两组实验,过程如下: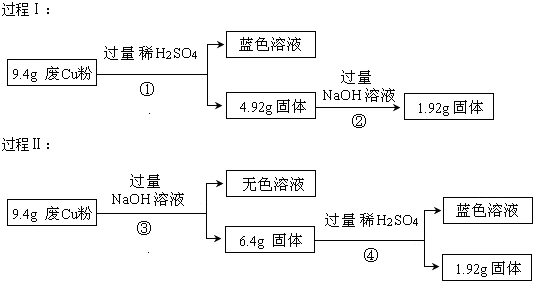
(1)废Cu粉中一定含有的杂质是(填化学式);
(2)写出过程①③中可能发生的所有反应的离子方程式:①;
③;
(3)综合过程Ⅰ、II,计算该9.4g废Cu粉中,m(SiO2)= , m(Cu)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是( )
A.温度相同、体积相同的O2和N2
B.体积相等、密度不等的CO和C2H4
C.质量相等、密度不等的N2和C2H4
D.压强相同、体积相同的N2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌.以下是用过氧化氢法生产亚氯酸钠的工艺流程图: 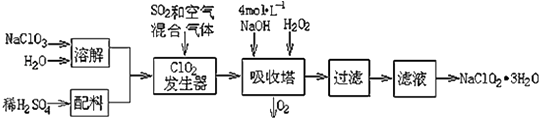
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O;
②Ksp(FeS)=6.3×10﹣18; Ksp(CuS)=6.3×10﹣36;Ksp(PbS)=2.4×10﹣28
(1)吸收塔内发生反应的离子方程式为 . 该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2 . 若用二氧化氯和浓盐酸制取Cl2 , 当生成5mol Cl2时,通过还原反应制得氯气的质量为g.
(2)从滤液中得到NaClO23H2O晶体的所需操作依次是(填写序号). a.蒸馏 b.灼烧 c.过滤 d.冷却结晶 e.蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2 . 表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | HCN | H2S |
Ka | 1×10﹣2 | 6.3×10﹣4 | 4.9×10﹣10 | K1=9.1×10﹣8 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为(用化学式表示);体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:(填“前者大”“相等”或“后者大”).
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是;当最后一种离子沉淀完全时(该离子浓度为10﹣5molL﹣1),此时体系中的S2﹣的浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法中正确的是( )
A.陶瓷、玻璃、水泥容器都能贮存氢氟酸
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞的试剂瓶中
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2 ![]() CO2+Na2SiO3可知硅酸的酸性大于碳酸
CO2+Na2SiO3可知硅酸的酸性大于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的实验装置用来分离CO2和CO气体并干燥.图中a为止水夹,b为分液漏斗的活塞,通过Y形管和止水夹分别接c、d两球胆,现装置内的空气已排尽.为使实验成功,甲、乙、丙中盛放的溶液分别为( ) 
A.NaHCO3饱和溶液、12 molL﹣1 盐酸,18.4 molL﹣1 H2SO4
B.Na2CO3饱和溶液、2 molL﹣1 H2SO4、NaOH饱和溶液
C.NaOH饱和溶液、2 molL﹣1 H2SO4、18.4 molL﹣1 H2SO4
D.18.4 molL﹣1 H2SO4、NaOH饱和溶液、18.4 molL﹣1 H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com