
【题目】某科研小组探究工业废Cu粉(杂质可能含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO45H2O,实现废物综合利用.他们进行了两组实验,过程如下: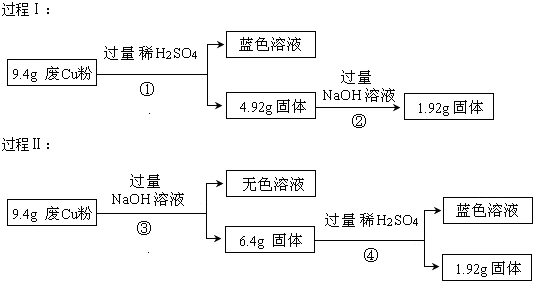
(1)废Cu粉中一定含有的杂质是(填化学式);
(2)写出过程①③中可能发生的所有反应的离子方程式:①;
③;
(3)综合过程Ⅰ、II,计算该9.4g废Cu粉中,m(SiO2)= , m(Cu)= .
【答案】
(1)SiO2、Fe2O3
(2)Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;SiO2+2OH﹣═SiO ![]() +H2O、Al2O3+2OH﹣=2AlO2﹣+H2O
+H2O、Al2O3+2OH﹣=2AlO2﹣+H2O
(3)3.0g;3.2g
【解析】解:由过程Ⅰ可知,9.4gX和过量盐酸反应生成蓝色溶液,所以是铜离子的颜色,但是金属Cu和盐酸不反应,所以一定含有氧化铁,和盐酸反应生成的三价铁离子可以和金属铜反应,二氧化硅可以和氢氧化钠反应,4.92g固体和氢氧化钠反应后,固体质量减少了3.0g,所以该固体为二氧化硅,质量为3.0g,涉及的反应有:Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=2Fe2++Cu2+、SiO2+2NaOH=Na2SiO3+H2O,又Cu与NaOH不反应,1.92g固体只含Cu;由过程Ⅱ可知,9.4gX与过量的氢氧化钠溶液反应后得到6.4g不溶物,固体部分溶解,原固体中至少含有Al2O3、SiO2的一种物质;6.4g固体与过量的盐酸反应得到蓝色溶液,蓝色溶液中存在铜离子,发生了反应:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+ , 说明溶液中一定存在Fe2+、H+、Cu2+ , 1.92g固体为铜,所以没有Fe3+ , (1)由过程Ⅰ可知含有SiO2 , 由过程Ⅱ可知含有Fe2O3 , 所以答案是:SiO2、Fe2O3;(2)由I可知X中一定存在的是Cu、Fe2O3、Al2O3 , 离子方程式分别为Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+ , ③涉及反应有SiO2+2OH﹣═SiO ![]() +H2O、Al2O3+2OH﹣=2AlO
+H2O、Al2O3+2OH﹣=2AlO ![]() +H2O,所以答案是:Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;SiO2+2OH﹣═SiO
+H2O,所以答案是:Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;SiO2+2OH﹣═SiO ![]() +H2O、Al2O3+2OH﹣=2AlO
+H2O、Al2O3+2OH﹣=2AlO ![]() +H2O;(3)通过以上分析可知,二氧化硅质量为3.0g,则Fe2O3、Cu一共6.4g,设Fe2O3为xmol,Cu为ymol, 则160x+64y=6.4
+H2O;(3)通过以上分析可知,二氧化硅质量为3.0g,则Fe2O3、Cu一共6.4g,设Fe2O3为xmol,Cu为ymol, 则160x+64y=6.4
Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+ ,
xmol 2xmol xmol 2xmol
则反应剩余的Cu为:(y﹣x)mol×64g/mol=1.92g,
解得:x=0.02,y=0.05,
则Fe2O3的质量为0.02mol×160g/mol=3.2g,
Cu的质量为0.05mol×64g/mol=3.2g,
所以答案是:3.0g;3.2g.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为_____________。

(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。T______100 ℃(填“大于”或“小于”),判断理由是____________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物.某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究: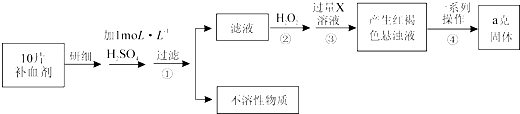
请回答下列问题:
(1)Ⅰ.①实验时用10molL﹣1的浓硫酸,配制100mL 1molL﹣1 H2SO4溶液,所需浓硫酸的体积为mL;②下列操作中,容量瓶所具备的功能有(填序号);
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.常用来代替量筒量取一定体积的液体 D.用来溶解固体溶质
③在下列配制过程示意图中,有错误的是(填写序号);
④下列说法正确的
A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
(2)Ⅱ.①步骤②加入过量H2O2后,溶液中主要存在的金属阳离子是;②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:a. , b.洗涤,c.灼烧,d.冷却
③若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2 . 
(1)A分子的质谱图如图所示,从图中可知其相对分子质量是 , 则A的分子式是;
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是 .
(3)A分子的核磁共振氢谱有4个吸收峰,峰面积之比是1:1:1:3,则A的结构简式是;
(4)写出两分子A生成六元环酯的化学方程式:;
(5)请写出官能团与A相同的同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法: 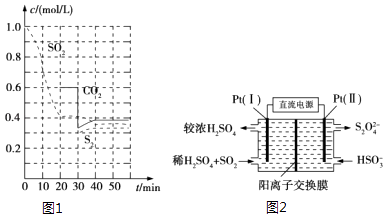
(1)活性炭还原法 反应原理:恒温恒容时2C(s)+2SO2(g)S2(g)+2CO2(g).
反应进行到不同时间测得各物质的浓度如图1:
①0~20min反应速率表示为v(SO2)=;
②30min时,改变某一条件平衡发生移动,则改变的条件最有可能是;
③能说明上述反应达到平衡状态的是 .
a.SO2 的消耗速率与CO2 的生成速率相同 b.混合气体的密度不变
c.S2的浓度不变 d.SO2 与S2的物质的量之比为2:1
(2)亚硫酸钠吸收法 ①Na2SO3溶液吸收SO2的离子方程式为;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是(填序号).
a.c(Na+)+c(H+)>c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
b.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
c.c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)
d.水电离出c(H+)=1×10﹣8 mol/L
(3)电化学处理法 ①如图2所示,Pt(Ⅰ)电极的电极反应式为;
②当电路中转移0.02mol e﹣时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加mol离子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基.Ⅰ可以用E和H在一定条件下合成: 
已知以下信息:
A的核磁共振氢谱表明其只有一种化学环境的氢;R﹣CH═CH2 ![]() R﹣CH2CH2OH
R﹣CH2CH2OH
化合物F苯环上的一氯代物只有两种;
通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.
回答下列问题:
(1)A的化学名称为 .
(2)D的结构简式为 .
(3)E的分子式为 .
(4)F生成G的化学方程式为 , 该反应类型为 .
(5)I的结构简式为 .
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2 , 共有种(不考虑立体异构).J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气的实验装置能达到实验目的或实验效果的是( ) 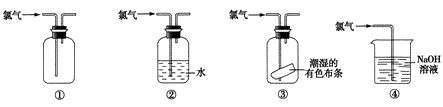
①可用于氯气的收集
②可用于除去氯气中少量的氯化氢气体
③可证明氯气具有漂白性
④可用于实验室氯气的尾气吸收.
A.①②
B.①③
C.②③
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.Na ![]() Na2O2
Na2O2 ![]() Na2CO3
Na2CO3
B.MgCO3 ![]() MgCl2溶液
MgCl2溶液 ![]() Mg
Mg
C.Fe ![]() Fe2O3
Fe2O3 ![]() Fe2(SO4)3
Fe2(SO4)3
D.SiO2 ![]() SiCl4
SiCl4 ![]() Si
Si
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com