
【题目】下列关于氯气的实验装置能达到实验目的或实验效果的是( ) 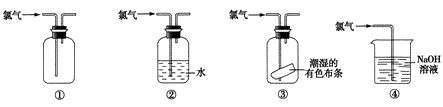
①可用于氯气的收集
②可用于除去氯气中少量的氯化氢气体
③可证明氯气具有漂白性
④可用于实验室氯气的尾气吸收.
A.①②
B.①③
C.②③
D.①④
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如图1所示. 
(1)为提高锌灰的浸取率,可采用的方法是(填序号).
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是(写化学式).
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S.
①检验ZnS固体是否洗涤干净的方法是 ,
②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取.化学反应方程式为
③已知Na2SO4 . 10H2O及Na2SO4的溶解度随温度变化曲线如图2.从滤液中得到Na2SO4.10H2O的操作方法是
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL,物质的量浓度为c mol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组探究工业废Cu粉(杂质可能含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO45H2O,实现废物综合利用.他们进行了两组实验,过程如下: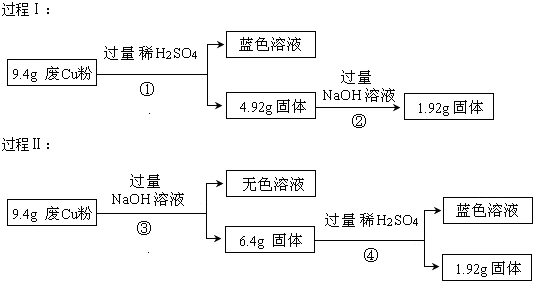
(1)废Cu粉中一定含有的杂质是(填化学式);
(2)写出过程①③中可能发生的所有反应的离子方程式:①;
③;
(3)综合过程Ⅰ、II,计算该9.4g废Cu粉中,m(SiO2)= , m(Cu)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌.以下是用过氧化氢法生产亚氯酸钠的工艺流程图: 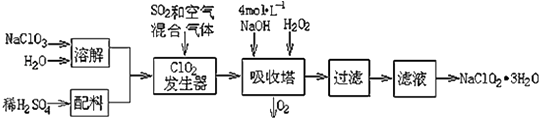
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O;
②Ksp(FeS)=6.3×10﹣18; Ksp(CuS)=6.3×10﹣36;Ksp(PbS)=2.4×10﹣28
(1)吸收塔内发生反应的离子方程式为 . 该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2 . 若用二氧化氯和浓盐酸制取Cl2 , 当生成5mol Cl2时,通过还原反应制得氯气的质量为g.
(2)从滤液中得到NaClO23H2O晶体的所需操作依次是(填写序号). a.蒸馏 b.灼烧 c.过滤 d.冷却结晶 e.蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2 . 表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | HCN | H2S |
Ka | 1×10﹣2 | 6.3×10﹣4 | 4.9×10﹣10 | K1=9.1×10﹣8 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为(用化学式表示);体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:(填“前者大”“相等”或“后者大”).
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是;当最后一种离子沉淀完全时(该离子浓度为10﹣5molL﹣1),此时体系中的S2﹣的浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断合理的是
A.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
B.将SO2分别通入品红和溴水溶液,溶液都会褪色,而且再经加热都能恢复原色
C.浓H2SO4,具有强氧化性,不能与Cu发生剧烈反应
D.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法中正确的是( )
A.陶瓷、玻璃、水泥容器都能贮存氢氟酸
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞的试剂瓶中
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2 ![]() CO2+Na2SiO3可知硅酸的酸性大于碳酸
CO2+Na2SiO3可知硅酸的酸性大于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表有____个横行,叫周期,每一周期中元素原子的_________相同,从左到右元素的金属性____(填增强或减弱);元素周期表中有_____列,第ⅥA族处在第_____列,同一主族从上到下,元素的非金属性依次_______(填增强或减弱)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.将碳与浓硫酸共热反应后的气体混合物通入过量氢氧化钠溶液中CO2+SO2+3OH﹣=HSO3﹣+CO32﹣+H2O
B.向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO﹣+SO2+H2O=2HClO+CaSO3↓
C.向Fe(NO3)3溶液中加入过量的HI溶液 2NO3﹣+8H++6I﹣=3I2+2NO↑+4H2O
D.将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A.加入10mL 0.01molL﹣1的NaOH溶液
B.加入10mL 的水进行稀释
C.加水稀释成100mL
D.加入10mL 0.01molL﹣1的盐酸溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com