
����Ŀ��ʵ������98%���ܶ�Ϊ1.84g/cm3��Ũ��������0.2mol/L��H2SO4��Һ450mL.
��1����Ҫʹ�õ���Ҫ��������Ͳ���ձ����������� �� ��
��2�����������ɷֽ�Ϊ���¼�����
A������Ͳ��ȡ mLŨ���ᣬ����ע��װ��Լ50mL����ˮ���ձ�����ò��������衣
B������������ˮ������ϴ���ձ��Ͳ���������ÿ�ε�ϴҺ����������ƿ�
C����ϡ�ͺ������С�ĵ��ò�������������ƿ�
D���������ƿ�Ƿ�©ˮ��
E��������ˮֱ�Ӽ�������ƿ����Һ��ӽ��̶���1-2cm����
F���ǽ�ƿ���������ߵ���ҡ����Һ��
G���ý�ͷ�ι�������ƿ����μ�������ˮ����Һ����͵�ǡ����������С�
��ݴ���д��
��������������еĿհ״���
�����������ȷ�IJ���˳������ĸ��д����
�� D ������ A ������ ������ ������ ������ ������ F ����
����Ũ�������ձ���ϡ�ͺ���������ƿʱ������_________________������Һ.
��3���Է������в�����������Һ��Ũ���к�Ӱ��
����ȡŨ����ʱ�۾����ӿ̶��ߣ��ᵼ��������ҺŨ�Ȼ� ����� ƫ�ߡ�ƫ�͡�����Ӱ�죬��ͬ��
������ʱ���۾����ӿ̶��ߣ�������ҺŨ�Ȼ� ��
�����ݺӸǵ�תҡ�Ⱥ���������ڿ̶��ߣ��ֵμ�����ˮ���̶ȡ�������ҺŨ�Ȼ� .
���𰸡���1��500ml����ƿ����ͷ�ι�
��2����5.4m����D ��A �� C �� B �� E ��G �� F ������ȴ������
��3����ƫ����ƫ����ƫ�͡�
�������������������1��һ�����ʵ���Ũ����Һ�����ƣ�ʵ�鲽��Ϊ���㡢��ȡ��ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ���������Ͳ��ȡ���õ���ͷ�ιܣ�Ũ���ᣬ���ձ���ϡ�ͣ����ò��������裬��ȴ��ת�Ƶ�500mL����ƿ�У����ò�����������ϴ�Ӻ�ϴ��Һ��������ƿ�У�����ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ����Ǻ�ƿ���ߵ�ҡ�ȡ���������������500mL����ƿ����ͷ�ιܡ�
��2�������ݹ�ʽc=![]() ����98%���ܶ�Ϊ1.84g/cm3��Ũ��������ʵ���Ũ��Ϊ18.4mol/L������ϡ�Ͷ��ɣ�ϡ��ǰ�����ʵ����ʵ������䣬������Ũ������������Ũ��������ΪxmL������xmL��18.4mol/L=500mL��0.2mol/L����ã�x=5.4������Ӧ��ȡ��Ũ���������5.4mL�������Ʋ�������ȡ��ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ���������Ͳ��ȡ���õ���ͷ�ιܣ�Ũ���ᣬ���ձ���ϡ�ͣ����ò��������裬��ȴ��ת�Ƶ�1000mL����ƿ�У����ò�����������ϴ�Ӻ�ϴ��Һ��������ƿ�У�����ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ����Ǻ�ƿ���ߵ�ҡ�ȡ����ò���˳��ΪD��A��C��B��E��G��F����Ũ����ϡ�ͷų������ȣ���Һ�����������������ʣ�δ��ȴ�����£����Ƚ���Һ��������ƿ���������Һ���ᵼ����Һ���ƫС����ҺŨ��ƫ��Ӧ����Һ��ȴ�����º�ת�Ƶ�500mL����ƿ�С�
����98%���ܶ�Ϊ1.84g/cm3��Ũ��������ʵ���Ũ��Ϊ18.4mol/L������ϡ�Ͷ��ɣ�ϡ��ǰ�����ʵ����ʵ������䣬������Ũ������������Ũ��������ΪxmL������xmL��18.4mol/L=500mL��0.2mol/L����ã�x=5.4������Ӧ��ȡ��Ũ���������5.4mL�������Ʋ�������ȡ��ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ���������Ͳ��ȡ���õ���ͷ�ιܣ�Ũ���ᣬ���ձ���ϡ�ͣ����ò��������裬��ȴ��ת�Ƶ�1000mL����ƿ�У����ò�����������ϴ�Ӻ�ϴ��Һ��������ƿ�У�����ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ����Ǻ�ƿ���ߵ�ҡ�ȡ����ò���˳��ΪD��A��C��B��E��G��F����Ũ����ϡ�ͷų������ȣ���Һ�����������������ʣ�δ��ȴ�����£����Ƚ���Һ��������ƿ���������Һ���ᵼ����Һ���ƫС����ҺŨ��ƫ��Ӧ����Һ��ȴ�����º�ת�Ƶ�500mL����ƿ�С�
��3������ȡŨ����ʱ�۾����ӿ̶��ߣ�ʹ��ȡ������Һ�����ƫ�ͣ�������ҺŨ��ƫ�ͣ�������ʱ���۾����ӿ̶��ߣ�ʹ��Һ�����ƫ�ͣ�������ҺŨ�Ȼ�ƫ�ߣ���ҡ�Ⱥ�Һ���½���һ������Һ����ƿ����ƿ��֮�䣬�ټ�����ˮ���̶��ߣ�������Һ���ƫ��������ҺŨ�Ȼ�ƫ�͡�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SiO2�㷺��������Ȼ���У����ڹ�ҵ���������Ź㷺����;��
(1)����(P4)����Ca3(PO4)2����̿��SiO2��һ�������·�Ӧ��á�����Ȼ�ѧ����ʽ���£�
2Ca3(PO4)2(s)��10C(s)==6CaO(s)��P4(s)��10CO(g) ��H1����3 359.26 kJ��mol��1
CaO(s)��SiO2(s)==CaSiO3(s) ��H2����89.61 kJ��mol��1
2Ca3(PO4)2(s)��6SiO2(s)��10C(s)==6CaSiO3(s)��P4(s)��10CO(g) ��H3 ��H3��________ kJ��mol��1��
(2)��ҵ����ʯӢɰ�ͽ�̿���Ƶôֹ衣
��֪��
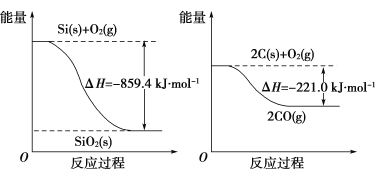
�뽫���·�Ӧ���Ȼ�ѧ����ʽ����������
SiO2(s)��2C(s)==Si(s)��2CO(g) ��H��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�500 ��ʱ��NH3��O2���ܷ������·�Ӧ��
��4NH3 (g)��5O2(g) ![]() 4NO(g)��6H2O(g)
4NO(g)��6H2O(g)
��H����9 072 kJ��mol��1 K��1.1��1026
��4NH3(g)��4O2(g) ![]() 2N2O(g)��6H2O(g)
2N2O(g)��6H2O(g)
��H����1104.9 kJ��mol��1 K��4.4��1028
��4NH3(g)��3O2(g) ![]() 2N2 (g)��6H2O(g)
2N2 (g)��6H2O(g)
��H����1 269.02 kJ��mol��1 K��7.1��1034
���У��ڡ����Ǹ���Ӧ����Ҫ���ٸ���Ӧ����ߵ�λʱ����NO�IJ��ʣ�������Ĵ�ʩ��( )
A������O2Ũ��
B��ʹ�ú��ʵĴ���
C����Сѹǿ
D�������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����������ʵ��������ǣ�NA��ʾ����٤��������
A. 1 mol CO2
B. ��״����44.8 L H2
C. 3NA��ˮ����
D. 1 L 1 mol/L��̼������Һ�к�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5L 2mol/L FeCl3��Һ��0.2L 5mol/L KCl��Һ�е�Cl�����ʵ���֮�ȣ� ��
A.6��5
B.3��2
C.15��2
D.3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Z��̬ԭ�ӵ�M����K���������ȣ���Z���������е�һ��������������Ԫ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��һ���Ϊ10 L�������У�ͨ��һ������CO��H2O����850 ��ʱ�������·�Ӧ��CO(g)��H2O(g) ![]() CO2(g)��H2(g)����H<0��CO��H2OŨ�ȱ仯��ͼ����0��4 min��ƽ����Ӧ����v(CO)��____ mol/(L��min)��
CO2(g)��H2(g)����H<0��CO��H2OŨ�ȱ仯��ͼ����0��4 min��ƽ����Ӧ����v(CO)��____ mol/(L��min)��
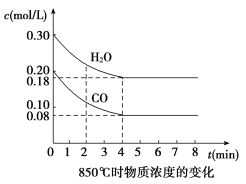
t1 ��ʱ����Ũ��(mol/L)�ı仯
ʱ��(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(2)t1 ��(����850 ��)ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯���ϱ�����ش�
�ٱ���3��4 min֮�䷴Ӧ����________״̬��c1��ֵ________0.08 mol/L(����ڡ�С�ڻ����)��
�ڷ�Ӧ��4��5 min�䣬ƽ�����淽���ƶ������ܵ�ԭ����________(��ѡ)������5��6 min֮����ֵ�����仯�����ܵ�ԭ����________(��ѡ)��
a��������ˮ�������� b�������¶�
c��ʹ�ô��� d����������Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���к͵ζ����ⶨij�ռ�Ĵ��ȣ�ʵ��������£�
��1�����ƴ���Һ����ȡ4.100 g�����ռ���Ʒ(���ʲ����ᷴӦ)���Ƴ�250 mL��Һ��
��2���ζ������� ��ȡ10.00 mL����Һ��������ƿ�м��뼸�η�̪����0��2000 mol��L��1�ı�����ζ������ռ���Һ���ߵα�ҡ����ƿ���۾�ע����ƿ����Һ��ɫ�ı仯��ֱ�� ʱֹͣ�ζ���
��3�����ݴ���
ʵ������� | ������Һ���V/mL | ����������Һ���V/mL |
1 | 19.90 | 10.00 |
2 | 20.10 | 10.00 |
3 | 22.00 | 10.00 |
4 | 20.00 | 10.00 |
������������ѡȡ���ʵ����ݣ��������������Һ�����ʵ���Ũ�� ���ռ�Ĵ���Ϊ (������λС��)��
��4��һ�����ʵ���Ũ����Һ�����ƺ�����к͵ζ�����ѧ��ѧ���������͵Ķ���ʵ�顣ij�о���ѧϰС����ʵ�����������������Һ��Ȼ������ζ�ijδ֪Ũ�ȵ�NaOH��Һ�������й�˵������ȷ���� (��ѡ)
A��ʵ�������õ��ĵζ��ܡ�����ƿ����ʹ��ǰ����Ҫ��©
B�����ʵ��������80 mL��ϡ�������Һ������ʱӦѡ��100 mL����ƿ
C������ƿ�к�����������ˮ���ᵼ���������Һ��Ũ��ƫС
D����ʽ�ζ���������ˮϴ�Ӻ�װ���Ũ�ȵ�ϡ���ᣬ���õ�NaOH��Һ��Ũ�Ƚ�ƫ��
E�����Ʊ���Һʱ������ʱ���Ӷ���������ʵ����ƫ��
F���к͵ζ�ʱ���������һ�ζ���ʱ���Ӷ���������ʵ����ƫ��
G����ƿ������ˮϴ��������������ˮ����������ʵ����ƫС
H���ζ�ǰ�ζ��ܼ��������ݣ��ζ���������ʧ������ʵ����ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ӵĵ�����ڹ�ҵ�Ͽ��õ��KI��Һ��ȡ���缫������ʯī�Ͳ���֣���ѧ����ʽ�ǣ�KI��3H2O![]() KIO3��3H2�����й�˵������ȷ����( )
KIO3��3H2�����й�˵������ȷ����( )
A��ʯī�������������������
B��I���������ŵ磬H���������ŵ�
C���������е������Һ��pH��С
D�����ת��3 mol e��ʱ�������Ͽ��Ƶ�KIO3107 g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com