
【题目】SiO2广泛存在于自然界中,其在工业生产中有着广泛的用途。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)==6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s)==CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)==6CaSiO3(s)+P4(s)+10CO(g) ΔH3 则ΔH3=________ kJ·mol-1。
(2)工业上用石英砂和焦炭可制得粗硅。
已知:
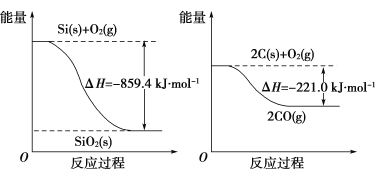
请将以下反应的热化学方程式补充完整:
SiO2(s)+2C(s)==Si(s)+2CO(g) ΔH=________。
【答案】(1)+2 821.6 (2)+638.4 kJ·mol-1
【解析】(1)根据反应2Ca3(PO4)2(s)+10C(s)==6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1 ①,CaO(s)+SiO2(s)==CaSiO3(s) ΔH2=-89.61 kJ·mol-1 ②,运用盖斯定律将①+②×6得:
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)==6CaSiO3(s)+P4(s)+10CO(g),则ΔH3=+3 359.26 kJ·mol-1-89.61 kJ·mol-1×6=+2 821.6 kJ·mol-1。(2)由题图可知Si(s)+O2(g)==SiO2(s) ΔH1=-859.4 kJ·mol-1,2C(s)+O2(g)==2CO(g) ΔH2=-221.0 kJ·mol-1,根据盖斯定律有:ΔH=ΔH2-ΔH1=+638.4 kJ·mol-1。


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】(1)请将5种物质: N2O、 FeSO4、 Fe(NO3)3、 HNO3 和 Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
______+______=______+______+______+H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1mol 氧化剂_______(填“得到”或“失去”) ___________ mol 电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中,标出电子转移的方向和数目(用单线桥表示)______+______→______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度 ②浓度 ③容量 ④ 压强 ⑤刻度线 ⑥酸式或碱式这六项中的
A. ②④⑥ B. ③⑤⑥ C. ①③⑤ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择一种容积将溴水中的溴萃取出来,这种溶剂应该具有的性质
A.易溶于水,且不与溴发生反应 B.不溶于水,且密度必须比水小
C.不溶于水,且密度必须比水大 D.不溶于水,且比水更容易使溴溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方案正确的是( )
A.氢氧化钠溶液中混有氢氧化钡(硫酸铜溶液)
B.二氧化碳气体中混有氯化氢(氢氧化钠溶液)
C.硝酸铜溶液中混有硝酸银(铜粉)
D.氧化钙中混有碳酸钠(稀盐酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,Ka(HCN)=6.2×10-10mol·L-1、Ka(HF)=6.8×10-4mol·L-1、Ka(CH3COOH)=1.8×10-5mol·L-1、Ka(HNO2)=6.4×10-6mol·L-1。物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
A. HCN溶液 B. HF溶液 C. CH3COOH溶液 D. HNO2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下混合液体: ①汽油和氯化钠溶液 ②乙醇与水 ③氯化钠溶液和单质溴,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的H2SO4溶液450mL.
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、 、 。
(2)其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):
( D )→( A )→( )→( )→( )→( )→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须_________________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视刻度线,会导致所配溶液浓度会 ;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛俯视刻度线,所配溶液浓度会 ;
③定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度。所配溶液浓度会 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com