
����Ŀ����1���뽫5�����ʣ� N2O�� FeSO4�� Fe(NO3)3�� HNO3 �� Fe2(SO4)3�ֱ����������Ӧ�ĺ����ϣ����һ��δ��ƽ����ѧ����ʽ��
______+______=______+______+______+H2O
��2����Ӧ���з���������Ӧ������__________������ԭ��Ԫ����_________��
��3����Ӧ��1mol ������_______����õ�����ʧȥ���� ___________ mol ���ӡ�
��4���뽫��Ӧ��Ļ�ѧʽ����ƽ���ϵ������������Ӧ��λ���У��������ת�Ƶķ������Ŀ���õ����ű�ʾ��______+______��______
���𰸡�(1)FeSO4+HNO3��Fe(NO3)3+Fe2(SO4)3+N2O+H2O��2����
(2)FeSO4��N ��ÿ��1����
(3)�õ���4 mol ��ÿ��1����
(4)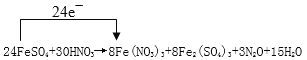 ��2����
��2����
��������
�������������������ԭ��Ӧ��������ԭ�����ϼ����������������ϼ۽���������HNO3Ϊ����������ԭΪN2O��FeSO4����ΪFe2(SO4)3�����Ա���ʽΪFeSO4+HNO3��Fe(NO3)3+Fe2(SO4)3+N2O+H2O��2����Ӧ���з���������Ӧ������FeSO4������ԭ��Ԫ����N����3���������õ���������ԭ��HNO3��Ϊ������������ԭΪN2O����Ӧ��1mol �������õ�����Ϊ��5-1����1=4 mol����4�����ݻ��ϼ�������ȹ�������ƽ����ʽ������24FeSO4+30HNO3��8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O������+2������+3�ۣ�ʧ1Ħ�����ӣ�24Ħ����ת��24e�� �����ű�ʾ����ת�����£�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2SO4��Al2��SO4��3�Ļ����Һ�У����Al3+Ũ��Ϊ0.1mol/L��SO42��Ũ��Ϊ0.3mol/L��������Һ��Na+��Ũ��Ϊ�� ��
A.0.15mol/L
B.0.45mol/L
C.0.6mol/L
D.0.3mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������ϵ�������У���ȫ��ȷ��һ����(����)
ѡ�� | ԭ�� | ���� |
A | ��ϩ�ͱ�����ʹ��ˮ��ɫ | �����Ӻ���ϩ���Ӻ�����ͬ��̼̼˫�� |
B | ��������к����Ȼ� | ����NaHCO3��Һ��Ӧ����CO2 |
C | ��ά�غ͵��۵Ļ�ѧʽ��Ϊ(C6H10O5)n | ���ǻ�Ϊͬ���칹�� |
D | ������������ϩ��һ�������¶�����ˮ��Ӧ | ��������ͬһ��Ӧ���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʹ�õĻ��˵�̺�����ϰ塢����Ȼ�����Ʒ�����ͷų�ij����Ⱦ���������壬��������
A. ���� B. ��ȩ C. �������� D. �Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�¡�ͬѹ�£�A�����ĵ�����B�����İ����У�������������ԭ������ȣ������������������֮����
A��2:1 C��2:3 B��1:2 D��1:3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʳ������Ӫ���DZ�֤���彡����������������Ҫ;����
��1�����ʵĹϹ��߲˴���_____________����Կ���Ԥ��____________�������и����óɷ�____________���� ������ĸ����
A��ţ�� B������ C������
��2��ijƷ��ʳƷ���ϱ�ǩ��һ������ͼ��

�������еĴ���������̬����Դ�ڻƶ��еĵ����ʷ���______��Ӧ�õ���
��С����е���ҪӪ��������_________��
�������У�������ɫ������ ��������ζ������__________�����ڷ���������___________��
����������8�ְ��������ͨ��ʳ��������ܻ�ȡ����8�ֲ�Ʒ�������Ϊ_______�����ᡣ
��3����ά����A�ֳ�________ά����������ĸ����
A���ӻƴ���ˮ���� B������Ѫ�ᣬˮ���� C���ӻƴ���֬����
������ҩ�������ڿ����ص���___________������ĸ����
A��������������Ƭ B����˾ƥ�� C����ù��
�� �ӵ����е�Ԫ�صĴ�����ʽ��__________������ĸ��
a��I2 b��KIO3 c��KI
����ʳƷ�ӹ������ҵ�У��ر�Ҫ�ϼӿ���������������_________������ĸ����
A���������� B��̼������ C���Ȼ���
���ۺ����á��ع��͡���һ�ַ����ǽ���ˮ���Ի�ȡ��֬�����__________������������
��ʹ���iù�ؿ��ܻ��������������ҩǰ����һ��Ҫ����______________��
������ҩ������θ������ԭ��������ҩ���к��е�һ�ֻ��ֻ�ѧ���ʣ�Al��OH��3�ǿ���ҩ��һ�֣���д������θ�ᷴӦ�����ӷ���ʽ________________��
���iù������ ��ѡ�����ҩ���Ǵ���ҩ������ͨ�����װ���ϱ���________��ѡ�OTC����R������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ķ����л���������п�ۺ�����ͭ(�����ɷֲ����ᷴӦ)��������������Ӵ��γ���ˮ������������������ˮ�����������ҷ�Ӧ��������ʣ�࣬��ʱ��ˮ��һ�����еĽ���������
A. Fe2+��Cu2+ B. Cu2+�� H+
C. Zn2+��Fe2+ D. Zn2+��H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ��ơ�ɳ��(��Ҫ�ɷ�ΪSiO2)��������������ɵĹ���������룬���ѧ�IJ���˳����
A. �ܽ⡢���ˡ�����(����)������(�ᾧ)B����(����)�� �ܽ⡢���ˡ�����(�ᾧ) B. �������ܽ⡢���ᾧ
C. �ܽ⡢�ᾧ�����ˡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SiO2�㷺��������Ȼ���У����ڹ�ҵ���������Ź㷺����;��
(1)����(P4)����Ca3(PO4)2����̿��SiO2��һ�������·�Ӧ��á�����Ȼ�ѧ����ʽ���£�
2Ca3(PO4)2(s)��10C(s)==6CaO(s)��P4(s)��10CO(g) ��H1����3 359.26 kJ��mol��1
CaO(s)��SiO2(s)==CaSiO3(s) ��H2����89.61 kJ��mol��1
2Ca3(PO4)2(s)��6SiO2(s)��10C(s)==6CaSiO3(s)��P4(s)��10CO(g) ��H3 ��H3��________ kJ��mol��1��
(2)��ҵ����ʯӢɰ�ͽ�̿���Ƶôֹ衣
��֪��
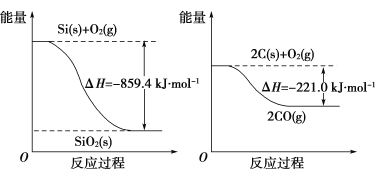
�뽫���·�Ӧ���Ȼ�ѧ����ʽ����������
SiO2(s)��2C(s)==Si(s)��2CO(g) ��H��________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com