
镁﹣H2O2酸性燃料电池是一种新型燃料电池,采用海水作电解质(加入一定量的酸),下列说法不正确的是()
A. 工作时,正极周围海水的pH增大
B. 电池总反应为:Mg+H2O2=Mg(OH)2
C. 正极发生的电极反应为:H2O2+2H++2e﹣=2H2O
D. 电池工作时,溶液中的H+向正极移动
考点: 化学电源新型电池.
专题: 电化学专题.
分析: 镁﹣H2O2酸性燃料电池中,镁为活泼金属,应为原电池的负极,被氧化,电极反应式为Mg﹣2e﹣═Mg2+,H2O2具有氧化性,应为原电池的正极,被还原,电极反应式为H2O2+2H++2e﹣═2H2O,根据电极反应式判断原电池总反应式,根据电极反应判断溶液PH的变化.
解答: 解:A.工作时,正极 反应式为H2O2+2H++2e﹣═2H2O,不断消耗H+离子,正极周围海水的pH增大,故A正确;
反应式为H2O2+2H++2e﹣═2H2O,不断消耗H+离子,正极周围海水的pH增大,故A正确;
B.电解质溶液呈酸性,不可能生成Mg(OH)2,电池总反应应为H2O2+2H++Mg═Mg2++2H2O,故B错误;
C.H2O2具有氧化性,应为原电池的正极,被还原,电极反应式为H2O2+2H++2e﹣=2H2O,故C正确;
D.原电池中,阳离子向正极移动,阴离子向负极移动,形成闭合回路,故D正确.
故选B.
点评: 本题考查原电池知识,题目难度中等,注意电极反应式的书写和电解质溶液的酸碱性.


科目:高中化学 来源: 题型:
如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )
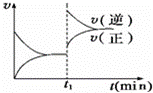
|
| A. | 2SO2(g)+O2(g)⇌2SO3(g);△H<0 |
|
| B. | 4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g);△H<0 |
|
| C. | H2(g)+I2(g)⇌2HI(g);△H>0 |
|
| D. | C(s)+H2O(g)⇌CO(g)+H2(g);△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化铝广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2+3C=2AlN+3CO合成.下列叙述正确的是()
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 molAlN需转移3 mol电子
C. AlN中氮元素的化合价为+3
D. AlN的摩尔质量为41g
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1mol H2O2放出热量98kJ,在含少量I﹣的溶液中,H2O2分解的机理为:
H2O2+I﹣→H2O+IO﹣ 慢
H2O2+IO﹣→H2O+O2+I﹣ 快
下列有关该反应的说法正确的是()
A. 反应速率与I﹣的浓度有关 B. IO﹣也是该反应的催化剂
C. 反应活化能等于98kJ•mol﹣1 D. v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中通入X并发生反应:2X(g)⇌Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是()

A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,v(Y)=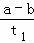 mol•L﹣1•min﹣1
mol•L﹣1•min﹣1
C. M点的正反应速率V正大于N点的逆反应速率V逆
D. M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关能量转换的说法正确的是()
A. 煤燃烧是化学能转化为热能的过程
B. 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C. 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D. 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
实验编号 反应物 催化剂
① 10mL2% H2O2溶液 无
② 10mL5% H2O2溶液 无
③ 10mL5% H2O2溶液 1mL0.1mol•L﹣1FeCl3溶液
④ 10mL5% H2O2溶液+少量HCl溶液 1mL0.1mol•L﹣1FeCl3溶液
⑤ 10mL5% H2O2溶液+少量NaOH溶液 1mL0.1mol•L﹣1FeCl3溶液
(1)催化剂能加快化学反应速率的原因是 .
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为 .
(3)实验①和②的目的是 .实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是 ).
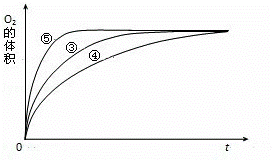
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.
分析上图能够得出的实验结论是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com