
氮化铝广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2+3C=2AlN+3CO合成.下列叙述正确的是()
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 molAlN需转移3 mol电子
C. AlN中氮元素的化合价为+3
D. AlN的摩尔质量为41g
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
某学生的实验报告所列出的下列数据中合理的是( )
|
| A. | 用10mL量筒量取7.13mL稀盐酸 |
|
| B. | 用托盘天平称量25.20gNaCl |
|
| C. | 用广泛pH试纸测得某溶液的pH为2.3 |
|
| D. | 用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有阳离子交换膜、阴离子交换膜、石墨电极,请用氯碱工业中的膜技术原理,回答下列问题.
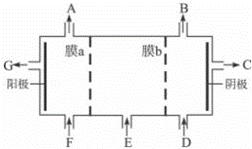
(1)写出氯碱工业中电解饱和食盐水的离子方程式 ;
(2)请利用交换膜技术,根据上图框架,设计一个电解硫酸钠溶液制氢氧化钠溶液和硫酸溶液的装置,标出进出物质的化学式:
A ;C ; E ;膜b为 离子交换膜(填“阳”或“阴”).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是()
A. 催化剂可以改变化学反应速率
B. 2 mol SO2与l mol O2混合一定能生成2 mol SO3
C. 食物放在冰箱中会减慢食物变质的速率
D. 化学反应达到反应限度时,正反应的速率与逆反应的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列应用或事实中,与胶体的制备或性质没有关系的是()
A. 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
B. 用石膏或盐卤点制豆腐
C. 将植物油倒入水中用力搅拌形成油水混合物
D. 氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
分类方法在化学学科发展中起到了非常重要的作用.下列分类标准合理的是()
①根据其溶液是否导电,将物质分为电解质和非电解质
②依据反应中有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
③根据反应是否有离子参加将反应分为离子反应和非离子反应
④根据组成元素的种类,将纯净物分为单质和化合物
⑤根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体.
A. ①②③④ B. ②③④⑤ C. ②③④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O═NaBO2+4H2↑下列说法中正确的是(NaBH4中H元素为﹣1价)()
A. NaBH4既是氧化剂又是还原剂
B. NaBH4是还原剂,H2O是氧化剂
C. 硼元素被氧化,氢元素被还原
D. 被氧化的元素与被还原的元素质量比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
镁﹣H2O2酸性燃料电池是一种新型燃料电池,采用海水作电解质(加入一定量的酸),下列说法不正确的是()
A. 工作时,正极周围海水的pH增大
B. 电池总反应为:Mg+H2O2=Mg(OH)2
C. 正极发生的电极反应为:H2O2+2H++2e﹣=2H2O
D. 电池工作时,溶液中的H+向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com