
【题目】A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):
A![]() B
B![]() C
C
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为___________(填元素符号)
(2)若D是金属,C溶液在储存时应加入少量金属D,其理由是(用必要的文字和离子方程式表示)______
(3)若A、B、C为含同一种金属元素的无机化合物,且三种物质中有一种是白色不溶物。在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式_________、_________
(4)某一离子反应体系有反应物和产物共以下六种:MnO4-、H+、O2、H2O、H2O2、Mn2+。
①写出该氧化还原反应的离子方程式_______
②溶液随着酸性的增强氧化性不断增强,应选择_________(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
③如反应转移了0.6mo1电子,则产生的气体在标准状况下体积为__________
(5)一份溶液中可能含有K+、Al3+、Mg2+、Fe2+、 H+、NH4+、Cl-、HCO3-、ClO-、AlO2-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
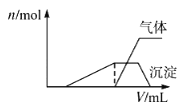
往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示;则该溶液中一定存在的离子是_______,一定不存在的离子是________。
【答案】Na 2Fe3++ Fe=3Fe2+ Al(OH)3+3H+=Al3++3H2O Al(OH)3+ OH-=AlO2-+2H2O 2MnO4-+6H++5H2O2=2Mn2++5O2↑+8 H2O 稀硫酸 6.72 L Al3+、H+、NH4+、Cl- Mg2+、Fe2+、HCO3-、ClO-、AlO2-
【解析】
(1)D是具有氧化性的单质,A元素属于短周期主族金属元素,根据反应关系可知A为Na,B为Na2O,D为O2,C为Na2O2;
(2)若D为金属,由转化关系可知为变价金属,应为Fe,则C含有Fe2+,具有还原性;
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为:Al3+→Al(OH)3→![]() ,D为OH-;或
,D为OH-;或![]() →Al(OH)3→Al3+,D为H+;
→Al(OH)3→Al3+,D为H+;
(4)由H2O2→O2知,双氧水在反应中作还原剂,所以还必须有氧化剂参加反应,在反应中得电子化合价降低,根据化合价知,高锰酸根离子作氧化剂,还原产物是锰离子,同时反应后生成水,反应的离子方程式为:![]() ,结合离子方程式解答;
,结合离子方程式解答;
(5)根据产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系的图示可以知道,刚加入氢氧化钠溶液时,没有产生沉淀;之后产生了沉淀,且沉淀完全溶解;沉淀溶解前产生了气体,该气体一定是氨气,以上分析依据,分别对离子存在情况作出判断。
(1)D是具有氧化性的单质,A元素属于短周期主族金属元素,根据反应关系可知A为Na,B为Na2O,D为O2,C为Na2O2;
(2)若D为金属,由转化关系可知为变价金属,应为Fe,则C含有Fe2+,具有还原性,保存时应加入少量Fe,防止被Fe2+空气氧化,原理是2Fe3++Fe=3Fe2+;
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B,判断为:Al3+→Al(OH)3→![]() ,A为Al3+,B为Al(OH)3,C为
,A为Al3+,B为Al(OH)3,C为![]() ,D为NaOH;或
,D为NaOH;或![]() →Al(OH)3→Al3+,A为
→Al(OH)3→Al3+,A为![]() ,B为Al(OH)3,C为Al3+,D为H+;B转化为C的离子方程式为:
,B为Al(OH)3,C为Al3+,D为H+;B转化为C的离子方程式为:![]() ;Al(OH)3+3H+=Al3++3H2O;
;Al(OH)3+3H+=Al3++3H2O;
(4)①由上述分析可知,该氧化还原反应离子方程式为:![]() ;
;
②高锰酸钾具有强氧化性,可氧化盐酸生成氯气,应用稀硫酸酸化;
③![]() 反应中,Mn元素化合价由+7价降低到+2价,由方程式可知生成5mol氧气转移10mol电子,则如反应转移了0.6mo1/span>电子,产生的氧气0.3mol,气体在标准状况下体积为0.3mol×22.4L/mol=6.72L;
反应中,Mn元素化合价由+7价降低到+2价,由方程式可知生成5mol氧气转移10mol电子,则如反应转移了0.6mo1/span>电子,产生的氧气0.3mol,气体在标准状况下体积为0.3mol×22.4L/mol=6.72L;
(5)根据图示,开始时没有沉淀生成,说明溶液中H+,一定没有ClO、![]() 、
、![]() ;随后出现沉淀,且沉淀完全溶解了,说明沉淀是氢氧化铝,溶液中一定含有Al3+,因Al3+与
;随后出现沉淀,且沉淀完全溶解了,说明沉淀是氢氧化铝,溶液中一定含有Al3+,因Al3+与![]() 、ClO-能够发生反应,则一定没有
、ClO-能够发生反应,则一定没有![]() 、ClO-;氢氧化铝溶解前生成了气体,该气体一定是氨气,故溶液中一定含有
、ClO-;氢氧化铝溶解前生成了气体,该气体一定是氨气,故溶液中一定含有![]() ;最终沉淀完全溶解,因此溶液中一定不含Mg2+、Fe2+;故答案为:Al3+、H+、
;最终沉淀完全溶解,因此溶液中一定不含Mg2+、Fe2+;故答案为:Al3+、H+、![]() 、Cl-;Mg2+、Fe2+、
、Cl-;Mg2+、Fe2+、![]() 、ClO-、
、ClO-、![]() 。
。


科目:高中化学 来源: 题型:
【题目】常温下,下列有关溶液的说法正确的是( )
A.pH相等的①NH4Cl②NH4Al(SO4)2③NH4HSO4溶液:NH4+浓度的大小顺序为①>②>③
B.常温下,pH为5的氯化铵溶液和pH为5的醋酸溶液中水的电离程度相同
C.HA的电离常数Ka=4.93×10-10,则等浓度的NaA、HA混合溶液中:c(Na+)>c(HA)>c(A-)
D.已知在相同条件下酸性HF>CH3COOH,则物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+)-c(F-)>c(K+)-c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组粒子在指定溶液中能大量共存的是
A.含大量Fe3+的溶液中:NH4+、Mg2+、Cl-、HS-
B.加入Al有H2生成的溶液中Cu2+、NH4+、Cl-、NO3-
C.使酚酞变红的溶液中:K+、Na+、AlO2-、CO32-
D.小苏打溶液中:K+、Al3+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
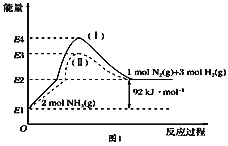
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为___________________.
②过程(Ⅰ)和过程(Ⅱ)的反应热________(填“相同”或“不同”).
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为____________.
b.N2的平衡转化率为________.
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡________(填“正向”“逆向”或“不”)移动.
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g)![]() 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=_____(用含a、c的代数式表示),K3=_____(用K1和K2表示).反应Ⅲ中的ΔS______(填“>”“<”或“=”)0.
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:
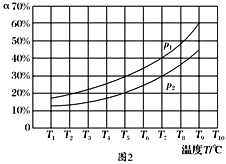
①分析得p1________p2.(填“>”“<”或“=”)
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是________(填序号).
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料(NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理为:![]()
![]()
![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A. 充电时,阴极质量减小且Na+数目增加
B. 充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
C. 放电时,Na+向正极移动
D. 放电时,负极的电极反应式为NamCn-me-=mNa++Cn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)达到平衡,保持温度不变,加入少量水蒸气,体系重新达到平衡,下列说法正确的是
Fe3O4(s)+4H2(g)达到平衡,保持温度不变,加入少量水蒸气,体系重新达到平衡,下列说法正确的是
A.水蒸气的体积分数增大B.氢气的浓度增大
C.平衡常数变大D.铁的质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的核外电子排布式为____________________,有___________个未成对电子。
(2)磷的一种同素异形体一一白磷(P4)的立体构型为_______________,其键角为___________,推测其在CS2中的溶解度___________(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因_________________________________。
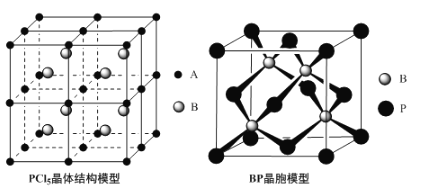
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如上左图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为___________,其中心原子杂化轨道类型为___________,B为___________。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,上图为其立方晶胞,其中的每个原子均测是8电子稳定结构,试判断其熔点___________(填“高于”或“低于”)金刚石熔点。已知其B—P键长均为xcm,则其密度为___________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com