
ЁОЬтФПЁПГЃЮТЯТЃЌЯТСагаЙиШмвКЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.pHЯрЕШЕФЂйNH4ClЂкNH4Al(SO4)2ЂлNH4HSO4ШмвКЃКNH4ЃЋХЈЖШЕФДѓаЁЫГађЮЊЂй>Ђк>Ђл
B.ГЃЮТЯТЃЌpHЮЊ5ЕФТШЛЏяЇШмвККЭpHЮЊ5ЕФДзЫсШмвКжаЫЎЕФЕчРыГЬЖШЯрЭЌ
C.HAЕФЕчРыГЃЪ§Ka=4.93ЁС10-10ЃЌдђЕШХЈЖШЕФNaAЁЂHAЛьКЯШмвКжаЃКc(NaЃЋ)>c(HA)>c(AЃ)
D.вбжЊдкЯрЭЌЬѕМўЯТЫсадHF>CH3COOHЃЌдђЮяжЪЕФСПХЈЖШЯрЕШЕФNaFгыCH3COOKШмвКжаЃКc(NaЃЋ)Ѓc(F-)>c(KЃЋ)Ѓc(CH3COO-)
ЁОД№АИЁПA
ЁОНтЮіЁП
AЃЎЧтРызгвжжЦяЇИљРызгЫЎНтЃЌNH4HSO4ШмвКГЪЧПЫсадЃЌNH4Al(SO4)2жаСНжжбєРызгЫЎНтЯдЫсадЃЌвЊЪЙетШ§жжШмвКЕФpHЯрЕШЃЌдђNH4ClКЭNH4Al(SO4)2ШмвКжабєРызгЕФЫЎНтГЬЖШЯрЕШЃЌСђЫсЧтяЇХЈЖШзюаЁЃЌЫљвдNH4ЃЋХЈЖШЕФДѓаЁЫГађЮЊЂй>Ђк>ЂлЃЌЙЪAе§ШЗЃЛ
BЃЎТШЛЏяЇШмвКжаяЇИљЫЎНтДйНјЫЎЕФЕчРыЃЌДзЫсШмвКжаДзЫсЕчРывжжЦЫЎЕФЕчРыЃЌЕБpHЯрЭЌЪБЃЌШмвКжаЫЎЕФЕчРыГЬЖШВЛЭЌЃЌЙЪBДэЮѓЃЛ
CЃЎKhЃН![]() ЃОKaЃЌПЩжЊЛьКЯШмвКжабЮЕФЫЎНтДѓгкШѕЫсЕФЕчРыЃЌдђЕШХЈЖШЕФNaAЁЂHAЛьКЯШмвКжаЃК c(HA)ЃОc(NaЃЋ)ЃОc(A)ЃЌЙЪCДэЮѓЃЛ
ЃОKaЃЌПЩжЊЛьКЯШмвКжабЮЕФЫЎНтДѓгкШѕЫсЕФЕчРыЃЌдђЕШХЈЖШЕФNaAЁЂHAЛьКЯШмвКжаЃК c(HA)ЃОc(NaЃЋ)ЃОc(A)ЃЌЙЪCДэЮѓЃЛ
DЃЎЫсадHFЃОCH3COOHЃЌдђЫсИљРызгЫЎНтГЬЖШFЃМCH3COOЃЌдђШмвКжаc(F)ЃОc(CH3COO)ЃЌЮяжЪЕФСПХЈЖШЯрЕШЕФNaFгыCH3COOKШмвКжагЩЮяСЯЪиКуЕУc(NaЃЋ)ЃНc(KЃЋ)ЃЌПЩжЊc(NaЃЋ)c(F)ЃМc(KЃЋ)c(CH3COO)ЃЌЙЪDДэЮѓЃЛ
ЙЪД№АИбЁAЁЃ


 ЦкФЉГхДЬ100ЗжДДаТН№ОэЭъШЋЪдОэЯЕСаД№АИ
ЦкФЉГхДЬ100ЗжДДаТН№ОэЭъШЋЪдОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛАуРДЫЕЃЌЖдвЛжжЮДжЊгаЛњЮяНсЙЙЕФВтЖЈжївЊАќРЈвдЯТМИИіЗНУцЃК
ЂйШЗЖЈЯрЖдЗжзгжЪСПЃЛ
ЂкВтЖЈдЊЫизщГЩЃЈжжРрКЭБШР§ЃЉЃЛ
ЂлбаОПИУгаЛњЮяЕФИїжжаджЪЃЛ
ЂмШЗЖЈНсЙЙЁЃ
ЃЈ1ЃЉЯрЖдЗжзгжЪСПЕФШЗЖЈвЛАуРћгУжЪЦзЗЈЃЌеєЦјУмЖШЗЈЕШЁЃФГгаЛњЮя![]() ЕФжЪЦзЭМЯдЪОЦфЯрЖдЗжзгжЪСПзюДѓЪЧ72ЁЃзщГЩдЊЫиЕФВтЖЈГЃВЩгУдЊЫиЗжЮівЧЃЌвВПЩВЩгУШМЩеЗЈЁЃГЦШЁ
ЕФжЪЦзЭМЯдЪОЦфЯрЖдЗжзгжЪСПзюДѓЪЧ72ЁЃзщГЩдЊЫиЕФВтЖЈГЃВЩгУдЊЫиЗжЮівЧЃЌвВПЩВЩгУШМЩеЗЈЁЃГЦШЁ![]()
![]() ЃЌдкзуСПбѕЦјжаГфЗжШМЩеЃЌЩњГЩЮяЭЈЙ§ХЈСђЫсКѓЃЌХЈСђЫсЕФжЪСПдіМг
ЃЌдкзуСПбѕЦјжаГфЗжШМЩеЃЌЩњГЩЮяЭЈЙ§ХЈСђЫсКѓЃЌХЈСђЫсЕФжЪСПдіМг![]() ЃЌЪЃгрЦјЬхЭЈЙ§МюЪЏЛвЃЌМюЪЏЛвЕФжЪСПдіМг
ЃЌЪЃгрЦјЬхЭЈЙ§МюЪЏЛвЃЌМюЪЏЛвЕФжЪСПдіМг![]() ЃЌдђ
ЃЌдђ![]() ЕФЗжзгЪНЮЊ______ЁЃ
ЕФЗжзгЪНЮЊ______ЁЃ
ЃЈ2ЃЉКЫДХЙВеёЦзГЃгУЧтЦзЛђЬМЦзЃЌЫќжївЊВтЖЈЗжзгжаОпгаВЛЭЌЬиЕуЕФ![]() Лђ
Лђ![]() ЕФжжРргыБШР§ЁЃШчЖдгкгаЛњЮя
ЕФжжРргыБШР§ЁЃШчЖдгкгаЛњЮя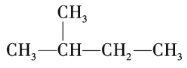 ЃЌЦф
ЃЌЦф![]() ЦзгаЫФИіЗхЃЌЗхИпБШЮЊ
ЦзгаЫФИіЗхЃЌЗхИпБШЮЊ![]() ЃЛ
ЃЛ![]() ЦзгаЫФИіЗхЃЌЗхИпБШЮЊ
ЦзгаЫФИіЗхЃЌЗхИпБШЮЊ![]() ЁЃгаЛњЮя
ЁЃгаЛњЮя![]() ЕФ
ЕФ![]() ЦзгаСНИіЗхЃЌЗхИпБШЮЊ
ЦзгаСНИіЗхЃЌЗхИпБШЮЊ![]() ЃЌЧтЦзгавЛИіЗхЁЃЪдаДГігаЛњЮя
ЃЌЧтЦзгавЛИіЗхЁЃЪдаДГігаЛњЮя![]() ЕФНсЙЙМђЪНЃК______ЁЃ
ЕФНсЙЙМђЪНЃК______ЁЃ
ЃЈ3ЃЉ![]() ЕФвЛТШДњЮяга______жжЃЌЖўТШДњЮяга______жжЁЃ
ЕФвЛТШДњЮяга______жжЃЌЖўТШДњЮяга______жжЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГФЃФтЁАШЫЙЄЪївЖЁБЕчЛЏбЇЪЕбщзАжУШчЭМЫљЪОЃЌИУзАжУФмНЋH2OКЭCO2зЊЛЏЮЊO2КЭШМСЯ(C3H8O)ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
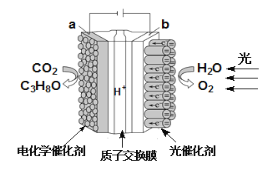
A.ИУзАжУЙЄзїЪБЃЌH+ДгaМЋЧјЯђbМЋЧјЧЈвЦ
B.ИУзАжУНЋЛЏбЇФмзЊЛЏЮЊЙтФмКЭЕчФм
C.aЕчМЋЕФЗДгІЪНЮЊ3CO2ЃЋ18HЃЋЃ18eЃ=C3H8OЃЋ5H2O
D.УПЩњГЩ3 mol O2ЃЌга88 g CO2БЛЛЙд
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЕчНтжЪШмвКЕФЫЕЗЈе§ШЗЕФЪЧ
A.Яђ0.1mol![]() CH3COOHШмвКжаМгШыЩйСПЫЎЃЌШмвКжа
CH3COOHШмвКжаМгШыЩйСПЫЎЃЌШмвКжа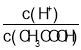 МѕаЁ
МѕаЁ
B.НЋCH3COONaШмвКДг20ЁцЩ§ЮТжС30ЁцЃЌШмвКжа![]() діДѓ
діДѓ
C.ЯђбЮЫсжаМгШыАБЫЎжСжаадЃЌШмвКжа![]() >1
>1
D.НЋ0.1mol/LЕФNaOHЕФЮТЖШЬсИпжС80ЁцЃЌШмвКЕФpHБфаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбаОПNO2ЁЂSO2 ЁЂCOЕШДѓЦјЮлШОЦјЬхЕФДІРэОпгаживЊвтвхЁЃ
ЃЈ1ЃЉвЛЖЈЬѕМўЯТЃЌНЋ2molNOгы2molO2жУгкКуШнУмБеШнЦїжаЗЂЩњШчЯТЗДгІЃК2NO(g)+O2(g)![]() 2NO2(g)ЃЌЯТСаИїЯюФмЫЕУїЗДгІДяЕНЦНКтзДЬЌЕФЪЧ_____________ЁЃ
2NO2(g)ЃЌЯТСаИїЯюФмЫЕУїЗДгІДяЕНЦНКтзДЬЌЕФЪЧ_____________ЁЃ
A.ЬхЯЕбЙЧПБЃГжВЛБф
B.ЛьКЯЦјЬхбеЩЋБЃГжВЛБф
C.NOКЭO2ЕФЮяжЪЕФСПжЎБШБЃГжВЛБф
D.УПЯћКФ1 molO2ЭЌЪБЩњГЩ2 molNO
ЃЈ2ЃЉCOПЩгУгкКЯГЩМзДМЃЌвЛЖЈЮТЖШЯТЃЌЯђЬхЛ§ЮЊ2LЕФУмБеШнЦїжаМгШыCOКЭH2ЃЌЗЂЩњЗДгІCO(g)+2H2(g)![]() CH3OH(g)ЃЌДяЦНКтКѓВтЕУИїзщЗжХЈЖШЃК
CH3OH(g)ЃЌДяЦНКтКѓВтЕУИїзщЗжХЈЖШЃК
ЮяжЪ | CO | H2 | CH3OH |
ХЈЖШЃЈmol/LЃЉ | 0.9 | 1.0 | 0.6 |
ЛиД№ЯТСаЮЪЬтЃК
ЂйЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСП=_________________ЁЃ
ЂкЦНКтГЃЪ§K=__________________ЁЃ
ЂлШєНЋШнЦїЬхЛ§бЙЫѕЮЊ1LЃЌВЛОМЦЫуЃЌдЄВтаТЦНКтжаc(H2)ЕФШЁжЕЗЖЮЇЪЧ__________ЁЃ
ЂмШєБЃГжЬхЛ§ВЛБфЃЌдйГфШы0.6molCOКЭ0.4molCH3OHЃЌДЫЪБvе§______vФцЃЈЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁА=ЁБЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжаГЩвЉСЌЛЈЧхЮСНКФвдкЖдПЙ H1N1ВЁЖОжаЗЂЛгжиДѓзїгУЃЌЦфгааЇГЩЗжТЬдЫсЕФНсЙЙМђЪНШчЭМЃЌЯТСагаЙиЫЕЗЈДэЮѓЕФЪЧ
A. ТЬдЫсЪєгкЗМЯузхЛЏКЯЮя
B. ЗжзгжажСЩйга 7 ИіЬМдзгЙВУц
C. 1mol ТЬдЫсзюЖрПЩЯћКФ 5mol NaOH
D. гыТЬдЫсБНЛЗЩЯШЁДњЛљжжРрМАИіЪ§ОљЯрЭЌЕФгаЛњЮяга5 жж
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯЁЭСдЊЫиЪЧБІЙѓЕФеНТдзЪдДЃЌЮвЙњЕФдЬВиСПОгЪРНчЪзЮЛЃЌЕЋНќФъРДЖдЦфНјааСЫТгЖсадПЊВЩЁЃЖўбѕЛЏюц(CeO2)ЪЧвЛжжживЊЕФЯЁЭСЛЏКЯЮяЁЃвдЗњЬМюцПѓ(жївЊКЌCeFCO3)ЮЊдСЯжЦБИCeO2ЕФвЛжжЙЄвеСїГЬШчЭМЃК
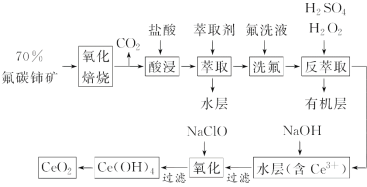
вбжЊЃКЂйCe4+ФмгыF-НсКЯГЩ[CeFx](4-x)+ЃЌвВФмгыSO42-НсКЯГЩ[CeSO4]2+ЃЛ
ЂкдкСђЫсЬхЯЕжаCe4+ФмБЛнЭШЁМС[(HA)2]нЭШЁЃЌЖјCe3+ВЛФмЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЁАбѕЛЏБКЩеЁБжаЁАбѕЛЏЁБЕФФПЕФЪЧ__ЁЃ
ЃЈ2ЃЉЁАЫсНўЁБжаЛсВњЩњДѓСПЛЦТЬЩЋЦјЬхЃЌаДГіCeO2гыбЮЫсЗДгІЕФРызгЗНГЬЪНЃК__ЁЃЮЊБмУтВњЩњЩЯЪіЮлШОЃЌЧыЬсГівЛжжНтОіЗНАИЃК__ЁЃ
ЃЈ3ЃЉЁАнЭШЁЁБЪБДцдкЗДгІЃКCe4++n(HA)2![]() CeЁЄ(H2n-4A2n)+4H+ЁЃШчЭМжаDЪЧЗжХфБШЃЌБэЪОCe(Ђє)ЗжБ№дкгаЛњВужагыЫЎВужаДцдкаЮЪНЕФЮяжЪЕФСПХЈЖШжЎБШ(D=
CeЁЄ(H2n-4A2n)+4H+ЁЃШчЭМжаDЪЧЗжХфБШЃЌБэЪОCe(Ђє)ЗжБ№дкгаЛњВужагыЫЎВужаДцдкаЮЪНЕФЮяжЪЕФСПХЈЖШжЎБШ(D=![]() )ЁЃБЃГжЦфЫћЬѕМўВЛБфЃЌDЫцЦ№ЪМСЯвКжаc(SO42-)БфЛЏЕФдвђЃК__(гУЦНКтвЦЖЏдРэНтЪЭ)ЁЃ
)ЁЃБЃГжЦфЫћЬѕМўВЛБфЃЌDЫцЦ№ЪМСЯвКжаc(SO42-)БфЛЏЕФдвђЃК__(гУЦНКтвЦЖЏдРэНтЪЭ)ЁЃ
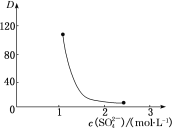
ЃЈ4ЃЉШєШБЩйЁАЯДЗњЁБЃЌдђЫљЕУВњЦЗЕФжЪСПНЋ__(ЬюЁАЦЋДѓЁБЁАЦЋаЁЁБЛђЁАВЛБфЁБ)ЁЃ
ЃЈ5ЃЉЁАЗДнЭШЁЁБжаЃЌH2O2зї__(ЬюЁАДпЛЏМСЁБЁАбѕЛЏМСЁБЛђЁАЛЙдМСЁБ)ЁЃ
ЃЈ6ЃЉЁАбѕЛЏЁБВНжшЕФЛЏбЇЗНГЬЪНЮЊ__ЁЃ
ЃЈ7ЃЉШЁЩЯЪіСїГЬжаЕУЕНЕФCeO2ВњЦЗ0.4000gЃЌМгСђЫсШмНтКѓЃЌгУ0.1000molЁЄL-1FeSO4БъзМШмвКЕЮЖЈжСжеЕуЪБ(юцБЛЛЙдЮЊCe3+ЃЌЦфЫћдгжЪОљВЛЗДгІ)ЃЌЯћКФ20.00mLБъзМШмвКЁЃИУВњЦЗжаCeO2ЕФжЪСПЗжЪ§ЮЊ__ЁЃЕЮЖЈЙ§ГЬжаПЩФмдьГЩЪЕбщНсЙћЦЋЕЭЕФЪЧ__(ЬюзжФИ)ЁЃ
A.ЪЙгУОУжУЕФFeSO4БъзМШмвК
B.ЕЮЖЈжеЕуЪБбіЪгЖСЪ§
C.зЖаЮЦПжаШмвКБфЩЋКѓСЂПЬЭЃжЙЕЮЖЈЃЌНјааЖСЪ§
D.ЕЮЖЈЙмМтзьФкЕЮЖЈЧАЮоЦјХнЃЌЕЮЖЈжеЕуЗЂЯжЦјХн
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫЎжЪМьбщжаЃЌВтЖЈЫЎЕФгВЖШЪБЃЌгУЕНАБ-ТШЛЏАБ![]() ЛКГхШмвКЃЌПижЦШмвКдк
ЛКГхШмвКЃЌПижЦШмвКдк![]() зѓгвЃЎдђЙигкИУЛКГхШмвКЕФЫЕЗЈВЛе§ШЗЕФЪЧ
зѓгвЃЎдђЙигкИУЛКГхШмвКЕФЫЕЗЈВЛе§ШЗЕФЪЧ
A.НЋЛКГхШмвКМгЫЎЯЁЪЭЪБЃЌpHвЛЖЈЛсМѕаЁ
B.НЋЛКГхШмвКЩ§ЮТЃЌpHвЛЖЈУЛгаБфЛЏ
C.дкЛКГхШмвКжаЃЌЫЎЕФЕчРыЪмЕНвжжЦ
D.дкЛКГхШмвКжаЃЌвЛЖЈга![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПAЁЂBЁЂCЁЂDОљЮЊжабЇЛЏбЇжаГЃМћЕФЮяжЪЃЌЫќУЧжЎМфзЊЛЏЙиЯЕШчЭМ(ВПЗжВњЮявбТдШЅ)ЃК
A![]() B
B![]() C
C
ЪдЛиД№ЃК
(1)ШєDЪЧОпгабѕЛЏадЕФЕЅжЪЃЌдђЪєгкжїзхЕФН№ЪєAЮЊ___________(ЬюдЊЫиЗћКХ)
(2)ШєDЪЧН№ЪєЃЌCШмвКдкДЂДцЪБгІМгШыЩйСПН№ЪєDЃЌЦфРэгЩЪЧ(гУБивЊЕФЮФзжКЭРызгЗНГЬЪНБэЪО)______
(3)ШєAЁЂBЁЂCЮЊКЌЭЌвЛжжН№ЪєдЊЫиЕФЮоЛњЛЏКЯЮяЃЌЧвШ§жжЮяжЪжагавЛжжЪЧАзЩЋВЛШмЮяЁЃдкШмвКжаAКЭCЗДгІЩњГЩBЁЃЧыаДГіBзЊЛЏЮЊCЕФЫљгаПЩФмЕФРызгСІГЬЪН_________ЁЂ_________
(4)ФГвЛРызгЗДгІЬхЯЕгаЗДгІЮяКЭВњЮяЙВвдЯТСљжжЃКMnO4-ЁЂH+ЁЂO2ЁЂH2OЁЂH2O2ЁЂMn2+ЁЃ
ЂйаДГіИУбѕЛЏЛЙдЗДгІЕФРызгЗНГЬЪН_______
ЂкШмвКЫцзХЫсадЕФдіЧПбѕЛЏадВЛЖЯдіЧПЃЌгІбЁдё_________(бЁЬюЁАЯЁСђЫсЁБЛђЁАХЈбЮЫсЁБ)НјааKMnO4ШмвКЕФЫсЛЏЁЃ
ЂлШчЗДгІзЊвЦСЫ0.6mo1ЕчзгЃЌдђВњЩњЕФЦјЬхдкБъзМзДПіЯТЬхЛ§ЮЊ__________
(5)вЛЗнШмвКжаПЩФмКЌгаK+ЁЂAl3+ЁЂMg2+ЁЂFe2+ЁЂ H+ЁЂNH4+ЁЂClЃЁЂHCO3ЃЁЂClOЃЁЂAlO2ЃЕШРызгжаЕФШєИЩжжЁЃЮЊСЫШЗЖЈШмвКЕФзщГЩЃЌНјааСЫШчЯТВйзїЃК
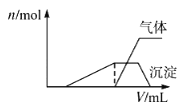
ЭљИУШмвКжаж№ЕЮМгШыNaOHШмвКВЂЪЪЕБМгШШЃЌВњЩњГСЕэКЭЦјЬхЕФЮяжЪЕФСП(n)гыМгШыNaOHШмвКЕФЬхЛ§ЙиЯЕШчЭМЫљЪОЃЛдђИУШмвКжавЛЖЈДцдкЕФРызгЪЧ_______ЃЌвЛЖЈВЛДцдкЕФРызгЪЧ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com