
【题目】稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位,但近年来对其进行了掠夺性开采。二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如图:
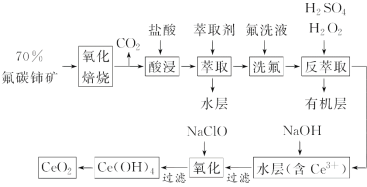
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是__。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:__。为避免产生上述污染,请提出一种解决方案:__。
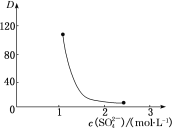
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce·(H2n-4A2n)+4H+。如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=
Ce·(H2n-4A2n)+4H+。如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=![]() )。保持其他条件不变,D随起始料液中c(SO42-)变化的原因:__(用平衡移动原理解释)。
)。保持其他条件不变,D随起始料液中c(SO42-)变化的原因:__(用平衡移动原理解释)。
(4)若缺少“洗氟”,则所得产品的质量将__(填“偏大”“偏小”或“不变”)。
(5)“反萃取”中,H2O2作__(填“催化剂”“氧化剂”或“还原剂”)。
(6)“氧化”步骤的化学方程式为__。
(7)取上述流程中得到的CeO2产品0.4000g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗20.00mL标准溶液。该产品中CeO2的质量分数为__。滴定过程中可能造成实验结果偏低的是__(填字母)。
A.使用久置的FeSO4标准溶液
B.滴定终点时仰视读数
C.锥形瓶中溶液变色后立刻停止滴定,进行读数
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
【答案】将+3价Ce氧化为+4价Ce 2CeO2+2Cl-+8H+=2Ce3++Cl2↑+4H2O 改用硫酸酸浸 随着c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,c(Ce4+)减小,萃取平衡向生成Ce4+的方向移动,D迅速减小 偏小 还原剂 2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl 86.00% CD
【解析】
氟碳铈矿(主要含CeFCO3),“氧化焙烧”的目的是将+3价铈氧化成+4价,Ce4+能与F-结合成[CeFx](4-x)+,以便后续的提取,加稀硫酸,与SO42-结合成[CeSO4]2+,加萃取剂,氟洗液,硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能,“反萃取”加H2O2,又将Ce4+还原为Ce3+,发生反应2Ce4++H2O2=2Ce3++O2↑+2H+,加入碱后Ce3+转化为沉淀,加入次氯酸钠将Ce从+3氧化为+4,加热分解得到产品,据此分析解答。
(1)CeFCO3中Ce显+3价,“氧化焙烧”中“氧化”的目的是将+3价铈氧化成+4价,故答案为:将+3价铈氧化成+4价;
(2)“酸浸”中会产生大量黄绿色气体为氯气,CeO2与盐酸发生氧化还原反应生成Ce3+和氯气,反应的离子方程式为2Cl-+8H++2CeO2=2Ce3++4H2O+Cl2↑,可以用硫酸代替盐酸,防止产生Cl2污染,故答案为:2Cl-+8H++2CeO2=2Ce3++4H2O+Cl2↑;改用硫酸酸浸;
(3)根据平衡:Ce4++n(HA)2Ce(H2n-4A2n)+4H+,加入Na2SO4时,随着c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,导致萃取平衡向左移动,D迅速减小,故答案为:随着c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,萃取平衡向生成Ce4+的方向移动,D迅速减小;
(4)若缺少“洗氟”,则会造成部分含铈物质损失,所得产品的质量将减少,故答案为:偏小;
(5)由流程图可知,经过反萃取后,Ce4+转化为Ce3+,“反萃取”加H2O2的作用是将Ce4+离子重新还原为Ce3+,反应的离子方程式为2Ce4++H2O2=2Ce3++O2↑+2H+,H2O2在该反应中作还原剂,故答案为:还原剂;
(6)“氧化”步骤中用次氯酸钠将Ce3+氧化成Ce4+,反应物为NaClO、Ce(OH)3,生成物为Ce(OH)4、NaCl,反应的离子方程式为2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl,故答案为:2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl;
(7)FeSO4的物质的量为0.1000molL-1×0.02L=0.002mol,根据电子得失守恒可得关系式CeO2~FeSO4,所以CeO2的质量为0.002mol×172g/mol=0.3440g,产品中CeO2的质量分数为![]() ×100%=86.00%;A.使用久置的FeSO4溶液滴定,硫酸亚铁被氧化,滴定过程中消耗溶液体积增大,测定结果偏高,故A错误;B.滴定终点时仰视读数,取标准溶液体积增大,测定结果偏高,故B错误;C.锥形瓶中溶液变色后立刻停止滴定,进行读数,消耗标准溶液体积减少,测定结果偏低,故C正确;D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,读取标准溶液体积偏小,测定结果偏低,故D正确;故答案为:86.00%;CD。
×100%=86.00%;A.使用久置的FeSO4溶液滴定,硫酸亚铁被氧化,滴定过程中消耗溶液体积增大,测定结果偏高,故A错误;B.滴定终点时仰视读数,取标准溶液体积增大,测定结果偏高,故B错误;C.锥形瓶中溶液变色后立刻停止滴定,进行读数,消耗标准溶液体积减少,测定结果偏低,故C正确;D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,读取标准溶液体积偏小,测定结果偏低,故D正确;故答案为:86.00%;CD。


科目:高中化学 来源: 题型:
【题目】2018年11月7~12日,首届长江上游城市花卉艺术博览会在重庆江北嘴举行。展会期间园艺工人定期给花卉喷洒一种新型杀虫剂M,其结构简式如图所示:
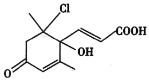
(1)一定条件下,1molM与NaOH溶液充分反应,最多消耗NaOH__mol。
(2)可在有机物M中引入羟基的反应类型是__(填序号)。
①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤还原反应 ⑥氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,熔点为-59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,实验室在50℃时制备ClO2。
实验Ⅰ:制取并收集ClO2,装置如图所示:
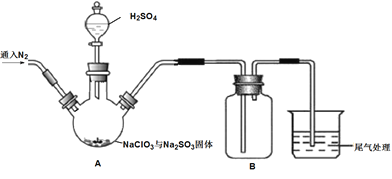
(1)写出用上述装置制取ClO2的化学反应方程式_____________。
(2)装置A中持续通入N2的目的是___________。装置B应添加__________(填“冰水浴”、“沸水浴”或“50℃的热水浴”)装置。
实验Ⅱ:测定装置A中ClO2的质量,设计装置如图:
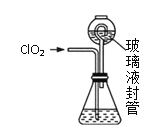
过程如下:
①在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
②按照右图组装好仪器;在玻璃液封管中加入①中溶液,浸没导管口;
③将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2—3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液;
④用c mol·L1 Na2S2O3标准液滴定锥形瓶中的液体,共用去V mL Na2S2O3溶液(已知:I2+2S2O32-=2I+S4O62-)。
(3)装置中玻璃液封管的作用是_____________。
(4)滴定终点的现象是___________________。
(5)测得通入ClO2的质量m(ClO2)=_______g(用整理过的含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关溶液的说法正确的是( )
A.pH相等的①NH4Cl②NH4Al(SO4)2③NH4HSO4溶液:NH4+浓度的大小顺序为①>②>③
B.常温下,pH为5的氯化铵溶液和pH为5的醋酸溶液中水的电离程度相同
C.HA的电离常数Ka=4.93×10-10,则等浓度的NaA、HA混合溶液中:c(Na+)>c(HA)>c(A-)
D.已知在相同条件下酸性HF>CH3COOH,则物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+)-c(F-)>c(K+)-c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H具有类似龙涎香、琥珀香的气味,香气淡而持久,被广泛用作香精的稀释剂和定香剂。合成该化合物的某种途径如图所示。
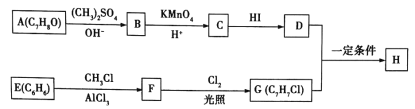
已知以下信息:
①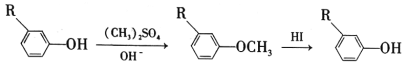 ;
;
②A的苯环上有四种化学环境不同的氢原子,且取代基的位置相邻;
③在D中滴加几滴FeCl3溶液,发生反应显出颜色;
④芳香烃F的相对分子质量介于90~100之间,0.1molF充分燃烧可生成7.2g水;
⑤R1COOH+RCH2C1![]() R1COOCH2R+HCl。
R1COOCH2R+HCl。
回答下列问题:
(1)A的化学名称是___________,由C生成D的反应的化学方程式为_______________。
(2)由F生成G的反应的化学方程式为____________________,反应类型为________________。
(3)H的结构简式为__________________。
(4)苯环上有三个取代基且其中两个与A中所含的官能团相同,同时又能发生银镜反应的C的同分异构体有___________(不考虑立体异构)种,其分子中有5种化学环境不同的氢原子,且氢原子个数之比为1:2:2:2:1的同分异构体的结构简式是_____________(任写一种即可)。
(5)苯酚经下图所示步骤可合成化合物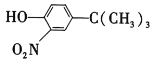 。
。
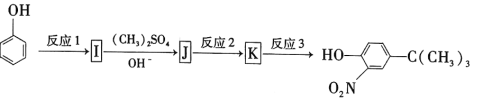
反应1所用的试剂为____________,K的结构简式为___________,反应3所用的试剂为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.100g30%CH3COOH溶液中含氢原子数为2NA
B.标准状况下,11.2LCCl4中含有的C—Cl键的数目为2NA
C.16gO3和O2混合物中含氧原子数为NA
D.精炼铜过程中阳极质量减少6.4g时,电路中转移电子数等于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应式为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是
A. 放电时负极的反应为:Zn-2e-+2OH-![]() Zn(OH)2
Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-![]() FeO42-+4H2O
FeO42-+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D. 放电时正极附近溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)达到平衡,保持温度不变,加入少量水蒸气,体系重新达到平衡,下列说法正确的是
Fe3O4(s)+4H2(g)达到平衡,保持温度不变,加入少量水蒸气,体系重新达到平衡,下列说法正确的是
A.水蒸气的体积分数增大B.氢气的浓度增大
C.平衡常数变大D.铁的质量增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com