
【题目】现有下列十种物质:①Na2O ②Cu(OH)2 ③Zn ④CaCO3 ⑤硫酸溶液 ⑥Ba(OH)2 ⑦干冰 ⑧A12(SO4)3 ⑨HCl水溶液 ⑩KHSO4
(1)其中属于非电解质的有_____________(填序号)。
(2)往②中加入过量的0.1 mol/L⑩的水溶液,发生反应的离子方程式是___________,向所得溶液中继续加入③,会产生无色气泡,该反应的离子方程式是_____________________。
(3)焊接铜器时,可先用NH4Cl除去其表面的氧化铜再进行焊接,该反应可表示为:4CuO+2NH4Cl![]() 3Cu+CuCl2+N2↑+4H2O
3Cu+CuCl2+N2↑+4H2O
①用双线桥标明电子转移的方向和数目。______________________ 。
②该反应中,被氧化的元素是 ,氧化剂是__________________。
③还原剂与氧化产物的物质的量之比为_________________。
④反应中若产生0.2 mol的氮气,则有_______________mol的电子转移。
【答案】 ⑦ Cu(OH)2+2H+= Cu2-+2H2O;Zn+2H+= Zn2++H2↑ 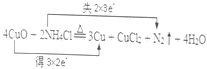 氮(N) CuO 2:1 1.2
氮(N) CuO 2:1 1.2
【解析】(1)①Na2O在熔融状态下能导电,是电解质;②Cu(OH)2在熔融状态下能导电,是电解质;③Zn是单质,既不是电解质,也不是非电解质;④CaCO3在熔融状态下能导电,是电解质;⑤硫酸溶液属于混合物,既不是电解质,也不是非电解质;⑥Ba(OH)2在水溶液里或熔融状态下能导电,是电解质;⑦干冰本身不能电离,属于非电解质;⑧A12(SO4)3在水溶液里或熔融状态下能导电,是电解质;⑨HCl水溶液属于混合物,既不是电解质,也不是非电解质;⑩KHSO4在水溶液里或熔融状态下能导电,是电解质;所以属于非电解质的是⑦;
(2)氢氧化铜与硫酸氢钠溶液反应实质是氢氧化铜与氢离子反应生成铜离子和水,离子方程式:Cu(OH)2+2H+═Cu2++2H2O;硫酸氢钠过量,加入锌,锌与氢离子反应生成氢气,离子方程式:Zn+2H+═Zn2++H2↑;
(3)①在反应过程中,铜化合价降低,失电子,氮元素化合价升高,得电子,所以双线桥法表示为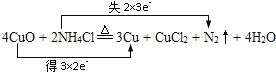 ;
;
②氮元素化合价升高,失去电子,被氧化;氧化铜中Cu元素的化合价降低,作氧化剂;
③还原剂是氯化铵,氧化产物是氮气,由反应可知,二者的物质的量之比为2∶1;
④氮元素化合价由-3降低为0价,生成0.2mol氮气对应失去电子为0.2×2×3=1.2mol。


科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4[Fe(CN)6],俗名黄血盐,可溶于水,不溶于乙醇。在化学实验、电镀、食品添加剂、烧制青花瓷时可用于绘画等方面有广泛用途。已知HCN是一种极弱的酸,现有一种用含NaCN的废水合成黄血盐的主要工艺流程如下:
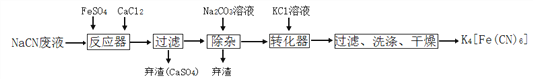
(1)常温下,NaCN水溶液的pH _______ 7(填“>”、“=”、“<”),实验室用NaCN固体配制NaCN溶液时,应先将其溶于_______溶液,再用蒸馏水稀释。
(2)反应器中发生的主要反应的化学方程式为 _____________________________。
(3)流程中加入Na2CO3溶液后过滤除去弃渣,过滤需要的玻璃仪器有烧杯、漏斗、______。
(4)转化器中生成K4[Fe(CN)6]的反应类型是________________,相同温度下,溶解度:K4[Fe(CN)6] _______ Na4[Fe(CN)6](填“>”、“=”、“<”) ,过滤后洗涤K4[Fe(CN)6]使用的试剂是________________。
(5)实验室常用K4[Fe(CN)6]检验Fe3+,生成难溶盐KFe[Fe(CN)6],试写出上述反应的离子方程式为 _________________________。
(6)含有14.7kg NaCN的工业废水可生产出9.2kg的K4[Fe(CN)6],则K4[Fe(CN)6]的产率是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点表示在t1℃两物质的溶解度关系为bc(填“>”、“<”或“=”).
(2)t2℃,a、b、c三种物质的饱和溶液溶质质量分数的大小关系为 .
(3)t2℃时,50g b物质加入到50g水中充分溶解后,所得溶液的质量为 .
(4)b中含有少量的a,若要提纯b,可采用结晶的方法.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钡样品23.1g中含有少量的氯化钠,某同学进行了如图所示的实验.请计算:
①过滤后得到沉淀多少克?
②原样品中氯化钡的质量分数?(计算结果精确到0.1%)
③求D烧杯中所得溶液的溶质质量分数是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国宣布到2030年非化石能源占一次能源消费比重将提高到20%左右。下列不属于化石能源的是
A. 煤 B. 生物质能 C. 天然气 D. 石油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一定体积的恒容密闭容器中进行可逆反应:X(g)+Y(g![]() Z(g) + W(s) △H>0,下列叙述正确的是
Z(g) + W(s) △H>0,下列叙述正确的是
A. 加入少量Z,逆反应速率增大
B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡向逆反应方向移动
D. 平衡后,加入X,该反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4(g) ![]() N2(g)+2H2(g) △H1
N2(g)+2H2(g) △H1
②N2(g)+3H2(g) ![]() 2NH3(g) △H2
2NH3(g) △H2
③7N2H4(g) ![]() 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3
△H3=___________(用含△H1和△H2的代数式表示),反应③的平衡行数表达式为K=___________。
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。

该反应的△H_____________(填“>”或“<”)0,N2H4发生分解反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧是人类最早利用的化学反应之一,与人类的生产、生活有密切的联系:
(1)如图是探究燃烧条件的实验,铜片上的白磷燃烧而水中的白磷不燃烧,说明燃烧需要;铜片上的白磷燃烧而红磷不燃烧,说明白磷的着火点比红磷的(填“高”或“低”).
(2)加油站、仓库等地方要张贴“禁止烟火”的标志,是因为这些地方存在着大量的 , 当遇火或温度较高时,会发生燃烧甚至爆炸.
(3)实验室用灯帽盖灭酒精灯火焰,其灭火的原理是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列物质的分离提纯问题。
Ⅰ.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X_______。
(2)证明AgNO3溶液加过量的实验方是_____________________________________________ 。(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________(填化学式),之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
Ⅱ.某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15mlCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(1)萃取过程正确操作步骤的顺序是:_________________________________ (填编号字母)。
(2)从含碘的CCl4溶液中提取碘 和回收CCl4,还需要经过蒸馏,观察下图所示实验装置指出其错误有______ 处。
(3)进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com