
【题目】某氯化钡样品23.1g中含有少量的氯化钠,某同学进行了如图所示的实验.请计算:
①过滤后得到沉淀多少克?
②原样品中氯化钡的质量分数?(计算结果精确到0.1%)
③求D烧杯中所得溶液的溶质质量分数是多少?
【答案】解:①设生成碳酸钡沉淀的质量为x,生成氯化钠的质量为y,参加反应的氯化钡的质量为z Na2CO3+BaCl2=BaCO3↓+2NaCl
106 208197 117
100g×10.6%zx y![]() ,
, ![]() ,
, ![]()
x=19.7g
y=11.7g
z=20.8g
所以过滤后得到沉淀是19.7g;
②原样品中氯化钡的质量分数为: ![]() ×100%=90.0%;
×100%=90.0%;
③D烧杯中所得溶液的溶质质量分数是: ![]() ×100%=7%.
×100%=7%.
故答案为:①过滤后得到沉淀是19.7g;②原样品中氯化钡的质量分数为90.0%;③D烧杯中所得溶液的溶质质量分数是7%.
【解析】①根据碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,依据碳酸钠的质量进行计算;②根据化学方程式计算原混合物中氯化钡的质量,然后计算氯化钡的质量分数;③根据题中的数据计算反应后,溶液D中溶质和溶液的质量,然后进行计算.本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.


科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.8 mol·L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.8 mol·L-1,则下列叙述正确的是
A. 平衡向正反应方向移动 B. x+y<z
C. B的物质的量浓度减小 D. C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SO2的叙述正确的是( )
A.SO2是具有漂白作用,可使石蕊褪色B.SO2与NaOH溶液反应生成Na2SO4
C.SO2能使溴水褪色,是因为SO2具有还原性D.SO2有毒,不能用作食品添加剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 一切物质中都存在化学键
B. 含有共价键的物质是共价化合物
C. 由非金属元素组成的化合物是共价化合物
D. 两个非金属元素原子间不可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以黄铜矿和硫磺为原料制取钢和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
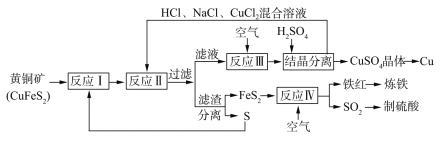
已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为________;
(2)“反应Ⅱ”的还原剂是________(填化学式);
(3)除CuS外“反应II”的产物还有_________(填化学式);
(4)“反应Ⅲ”的离子方程式为_________;
(5)某同学设想利用电化学原理实现以CuSO4、SO2为原料制备Cu和H2SO4,并吸收炼铁过程中产生的CO尾气,实现资源与能源的综合利用。该同学据此组装出的装置如下图所示:

闭合该装置中的K,A池中通入SO2的Pt电极的电极反应式为__________,B池中生成的气体X的电子式为________,若在C池中生成64gCu,则整个装置中共生成H2SO4_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①Na2O ②Cu(OH)2 ③Zn ④CaCO3 ⑤硫酸溶液 ⑥Ba(OH)2 ⑦干冰 ⑧A12(SO4)3 ⑨HCl水溶液 ⑩KHSO4
(1)其中属于非电解质的有_____________(填序号)。
(2)往②中加入过量的0.1 mol/L⑩的水溶液,发生反应的离子方程式是___________,向所得溶液中继续加入③,会产生无色气泡,该反应的离子方程式是_____________________。
(3)焊接铜器时,可先用NH4Cl除去其表面的氧化铜再进行焊接,该反应可表示为:4CuO+2NH4Cl![]() 3Cu+CuCl2+N2↑+4H2O
3Cu+CuCl2+N2↑+4H2O
①用双线桥标明电子转移的方向和数目。______________________ 。
②该反应中,被氧化的元素是 ,氧化剂是__________________。
③还原剂与氧化产物的物质的量之比为_________________。
④反应中若产生0.2 mol的氮气,则有_______________mol的电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1 ΔS=-280.1 J·mol-1·K-1。在常温、常压下反应能自发进行,对反应的方向起决定性作用的是( )
A. 熵变 B. 温度
C. 压强 D. 焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取气体的常见装置:
(1)仪器a的名称是;
(2)以A为发生装置,用高锰酸钾制取氧气,化学方程式为 , 试管口放一团棉花的作用是;
(3)以B为发生装置制取二氧化碳,加入药品之前要先检查装置的 , 收集二氧化碳通常选用(填标号);
(4)温度、浓度、固体的颗粒大小等因素会影响反应速率.为研究实验室制取二氧化碳的适宜条件,进行如
表四组实验:
实验编号 | 甲 | 乙 | 丙 | 丁 |
mg大理石 | 块状 | 块状 | 粉末状 | 粉末状 |
mg验算(过量) | 稀盐酸 | 浓盐酸 | 稀盐酸 | 浓盐酸 |
①大理石与盐酸反应的化学方程式是;
②实验甲与对照(填编号),是为了研究固体反应物颗粒大小对反应速率的影响;
③上述实验中,另一个影响反应速率的因素是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com