
ij�¶������ݻ�������ܱ������У�����aX��g��+bY��g�� cW��g����Ӧ��������1 mol X��lmol Y���ﵽƽ��ʱ��W��Ũ��Ϊ0��2 mol/L������˵���������
cW��g����Ӧ��������1 mol X��lmol Y���ﵽƽ��ʱ��W��Ũ��Ϊ0��2 mol/L������˵���������
A���ﵽƽ��ʱ������b mol Y��ͬʱ����c moI W
B���������¶ȣ�W�����ʵ���Ũ�ȼ�С����÷�Ӧ��H<0
C������ʼͶ��X��Y�����ʵ����ֱ�Ϊamol��bmol����ƽ��ʱX��Y��ת�������
D������ͬ�����£��ٳ���l mol X��1 mol Y������ƽ��ʱ��W��Ũ��Ϊ0��4 mol/L����a+b>c
D
��������
���������A������b mol Y������У�ͬʱ����c moI
W������У����ݷ�Ӧ����֮�ȵ�������֮�ȿ�֪����Ӧ�ﵽƽ�⣬��A��ȷ��B��aX��g��+bY��g��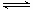 cW��g�����������¶ȣ�W�����ʵ���Ũ�ȼ�С��ƽ�����ƣ������������ȷ�Ӧ�����������Ƿ��ȷ�Ӧ����÷�Ӧ��H��0����B��ȷ��C������ʼͶ��X��Y�����ʵ����ֱ�Ϊamol��bmol������ƽ��ʱ�����ĵ�X��Y���ջ�ѧ����ʽ��������Ӧ���ģ�����ƽ��ʱX��Y��ת������ȣ���C��ȷ��D������ͬ�����£��ٳ���l mol X��1 mol Y������ƽ��ʱ��W��Ũ��Ϊ0.4 mol/L����˵��ƽ���ǵ�Ч�ģ����a+b��c����D����ѡD��
cW��g�����������¶ȣ�W�����ʵ���Ũ�ȼ�С��ƽ�����ƣ������������ȷ�Ӧ�����������Ƿ��ȷ�Ӧ����÷�Ӧ��H��0����B��ȷ��C������ʼͶ��X��Y�����ʵ����ֱ�Ϊamol��bmol������ƽ��ʱ�����ĵ�X��Y���ջ�ѧ����ʽ��������Ӧ���ģ�����ƽ��ʱX��Y��ת������ȣ���C��ȷ��D������ͬ�����£��ٳ���l mol X��1 mol Y������ƽ��ʱ��W��Ũ��Ϊ0.4 mol/L����˵��ƽ���ǵ�Ч�ģ����a+b��c����D����ѡD��
���㣺������淴Ӧƽ��״̬����Ӧ�ȡ�ת���ʵ��ж��Լ����������ƽ��״̬��Ӱ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ��ʼŨ�� | �� | �� | �� |
| c��H2��/mol/L | 0.010 | 0.020 | 0.020 |
| c��CO2��/mol/L | 0.010 | 0.010 | 0.020 |
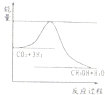
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�¶������ݻ�Ϊ2L���ܱ������У�����2Y��g��+Y��g��![]() 2W��g���ķ�Ӧ������1moLX��1molY����20s�ﵽƽ��ʱ������0.4molW������˵����ȷ���ǣ� ��
2W��g���ķ�Ӧ������1moLX��1molY����20s�ﵽƽ��ʱ������0.4molW������˵����ȷ���ǣ� ��
A���������¶ȣ�W�����������С����÷�Ӧ��H<0
B����Y��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.01mol/(L?s)
C���������������������£�����1molX����X��Y��ת���ʾ����
D������ѹǿ����Ӧ���������淴Ӧ���ʼ�С����ƽ��������Ӧ������ת
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com