
ú��ֱ��ȼ�����������ص���̬�ͻ�����Ⱦ��������ֱ��ȼ�պ��ѽ����������������⡣���ú̿������Ч�����������й���չ��̼���õĹؼ�����ͼ��ú�����ͳ����ʵ��ϵͳʾ��ͼ��

�����������
I��������ʵ���¶ȣ�ͨ�˸ߴ�N2����Ͷ�Ͽڼ���ʯӢɰ���������壩
��ֹͣͨ��N2���ӷ�Ӧ���·�������ͨ��ˮ������CO2����Ͷ�Ͽڼ���CaO
��ֹͣͨ��ˮ������CO2����Ͷ�Ͽڼ���ú
��������ͨ��ˮ������CO2����ʼ��Ӧ����������ڹ���ͨ�˸ߴ�N2
��1���������������� ��
��2����ʹ��CaCO3����CaO����CaCO3����Ļ�ѧ����ʽΪ ��
��3��ͨ��N2��Ŀ�ģ� ��
��4����Ӧ���з������¼��ַ�Ӧ��
C��s��ʮH2O��g��=CO��g��+H2��g�� ��H=+131kJ/mol
C��s��+O2��g��=CO2��g�� ��H=-394kJ/mol
CO��g��+![]() O2��g��=CO2��g�� ��H=-283kJ/mol
O2��g��=CO2��g�� ��H=-283kJ/mol
CO��g��+H2O��g��![]() H2��g��+CO2��g��
H2��g��+CO2��g��
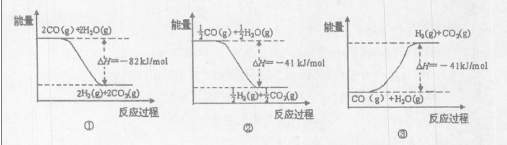
��ͼ�ܱ�ʾCO��H2O��g������CO2��H2�ķ�Ӧ���̺�������ϵ��ͼ�� ������ţ���
��5����֪830��ʱ��CO��g��+H2O��g��![]() H2��g��+CO2��g����ƽ�ⳣ��K=1�������ʵ�����CO��H2O��Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ .
H2��g��+CO2��g����ƽ�ⳣ��K=1�������ʵ�����CO��H2O��Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ .
��6��ú���������л���������CH4����֪CH4��CaSO4��Ӧ����CaS��CO2��H2O���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ ��
��7��ú�������������CO��H2��CH4����ɣ���������ȼ�ϵ�ء����м���������CH4���뷴Ӧ�ĵ缫��ӦʽΪ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2012?�Ĵ���ֱ���ŷ�úȼ�ղ������������������صĻ������⣬������ͨ��װ��ʯ��ʯ��Һ������װ�ÿ��Գ�ȥ���еĶ�������������������ƣ�����ƿ�����ͼ��ʾ��ѭ��ȼ��װ�õ�ȼ�Ϸ�Ӧ��������鷴Ӧ�������������ˮ��õ������������ʵĶ�����̼���Ӷ������ڶ�����̼�Ļ������ã��ﵽ����̼�ŷŵ�Ŀ�ģ�
��2012?�Ĵ���ֱ���ŷ�úȼ�ղ������������������صĻ������⣬������ͨ��װ��ʯ��ʯ��Һ������װ�ÿ��Գ�ȥ���еĶ�������������������ƣ�����ƿ�����ͼ��ʾ��ѭ��ȼ��װ�õ�ȼ�Ϸ�Ӧ��������鷴Ӧ�������������ˮ��õ������������ʵĶ�����̼���Ӷ������ڶ�����̼�Ļ������ã��ﵽ����̼�ŷŵ�Ŀ�ģ�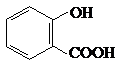 ��
��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�찲��ʡ������ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z��W��Ԫ�����ڱ���ԭ������������������ֶ�����Ԫ�أ��������Ϣ���±���
|
Ԫ�� |
�����Ϣ |
|
X |
ơ�ƺ������г�����X������������ƿ��ʱ�����������������ݳ� |
|
Y |
Y2�ǿ����к�����ߵ����嵥�� |
|
Z |
Z�Ļ�̬ԭ�����������Ų�ʽΪ2s22p4 |
|
W |
W��һ�ֺ���������Ϊ27��������Ϊ14 |
��1��Wλ��Ԫ�����ڱ��� ���ڵ� �壻Z��W��������Ӱ뾶��С��ϵΪ
�������ӷ��ű�ʾ��
��2��һ��X�γɵĵ��ʣ�����Ȼ��Ӳ���������ʣ����ۻ����ֵ��ʣ�����˷���������������� ��Y�ĵ縺�Ա�Z �����С����
��3��W�ĵ�����NaOH��Һ��Ӧ�����ӷ���ʽΪ �� W�ڸ��������¿ɻ�ԭ���۵�Ľ����������ƵĽ������ʣ�д��W��ԭCr2O3��Ӧ�Ļ�ѧ����ʽ�� ��
��4��úȼ�ղ�������������Y����������������صĻ������⣬��ˣ�����XH4����ԭ��������Ⱦ����֪��
XH4(g)+2 YO2(g)== Y2(g)+ XO2(g)+2H2O (g) ��H1= -867kJ/mol
2 YO2(g)  Y2O4(g)
��H2=-56.9kJ/mol
Y2O4(g)
��H2=-56.9kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�걱���з�̨��������ѧ��ͳһ��ϰ�����������ۣ���ѧ���� ���ͣ������
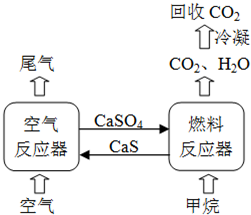
ú��ֱ��ȼ�����������ص���̬�ͻ�����Ⱦ��������ֱ��ȼ�պ��ѽ����������������⡣���ú̿������Ч�����������й���չ��̼���õĹؼ�����ͼ��ú�����ͳ����ʵ��ϵͳʾ��ͼ��
�����������
I��������ʵ���¶ȣ�ͨ�˸ߴ�N2����Ͷ�Ͽڼ���ʯӢɰ���������壩
��ֹͣͨ��N2���ӷ�Ӧ���·�������ͨ��ˮ������CO2����Ͷ�Ͽڼ���CaO
��ֹͣͨ��ˮ������CO2����Ͷ�Ͽڼ���ú
��������ͨ��ˮ������CO2����ʼ��Ӧ����������ڹ���ͨ�˸ߴ�N2
��1���������������� ��
��2����ʹ��CaCO3����CaO����CaCO3����Ļ�ѧ����ʽΪ ��
��3��ͨ��N2��Ŀ�ģ� ��
��4����Ӧ���з������¼��ַ�Ӧ��
C��s��ʮH2O��g��=CO��g��+H2��g�� ��H=+131kJ/mol
C��s��+O2��g��=CO2��g�� ��H=-394kJ/mol
CO��g��+ O2��g��=CO2��g�� ��H=-283kJ/mol
O2��g��=CO2��g�� ��H=-283kJ/mol
CO��g��+H2O��g�� H2��g��+CO2��g��
H2��g��+CO2��g��
��ͼ�ܱ�ʾCO��H2O��g������CO2��H2�ķ�Ӧ���̺�������ϵ��ͼ�� ������ţ���
��5����֪830��ʱ��CO��g��+H2O��g�� H2��g��+CO2��g����ƽ�ⳣ��K=1�������ʵ�����CO��H2O��Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ
.
H2��g��+CO2��g����ƽ�ⳣ��K=1�������ʵ�����CO��H2O��Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ
.
��6��ú���������л���������CH4����֪CH4��CaSO4��Ӧ����CaS��CO2��H2O���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ ��
��7��ú�������������CO��H2��CH4����ɣ���������ȼ�ϵ�ء����м���������CH4���뷴Ӧ�ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011�챱���з�̨��������ѧ��ͳһ��ϰ�����������ۣ���ѧ���� ���ͣ������
ú��ֱ��ȼ�����������ص���̬�ͻ�����Ⱦ��������ֱ��ȼ�պ��ѽ����������������⡣���ú̿������Ч�����������й���չ��̼���õĹؼ�����ͼ��ú�����ͳ����ʵ��ϵͳʾ��ͼ��
�����������
I��������ʵ���¶ȣ�ͨ�˸ߴ�N2����Ͷ�Ͽڼ���ʯӢɰ���������壩
��ֹͣͨ��N2���ӷ�Ӧ���·�������ͨ��ˮ������CO2����Ͷ�Ͽڼ���CaO
��ֹͣͨ��ˮ������CO2����Ͷ�Ͽڼ���ú
��������ͨ��ˮ������CO2����ʼ��Ӧ����������ڹ���ͨ�˸ߴ�N2
��1���������������� ��
��2����ʹ��CaCO3����CaO����CaCO3����Ļ�ѧ����ʽΪ ��
��3��ͨ��N2��Ŀ�ģ� ��
��4����Ӧ���з������¼��ַ�Ӧ��
C��s��ʮH2O��g��=CO��g��+H2��g�� ��H=+131kJ/mol
C��s��+O2��g��=CO2��g�� ��H=-394kJ/mol
CO��g��+ O2��g��=CO2��g�� ��H=-283kJ/mol
O2��g��=CO2��g�� ��H=-283kJ/mol
CO��g��+H2O��g�� H2��g��+CO2��g��
H2��g��+CO2��g��
��ͼ�ܱ�ʾCO��H2O��g������CO2��H2�ķ�Ӧ���̺�������ϵ��ͼ�� ������ţ���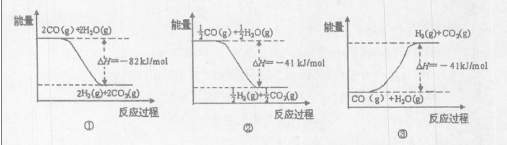
��5����֪830��ʱ��CO��g��+H2O��g�� H2��g��+CO2��g����ƽ�ⳣ��K=1�������ʵ�����CO��H2O��Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ .
H2��g��+CO2��g����ƽ�ⳣ��K=1�������ʵ�����CO��H2O��Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ .
��6��ú���������л���������CH4����֪CH4��CaSO4��Ӧ����CaS��CO2��H2O���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ ��
��7��ú�������������CO��H2��CH4����ɣ���������ȼ�ϵ�ء����м���������CH4���뷴Ӧ�ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com