
下列离子方程式书写正确的是
A.用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B.用铜为电极电解饱和食盐水:2Cl—+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
科目:高中化学 来源: 题型:
CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
| 物 质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol·L-1) | 0.5 | 0.5 | 2.0 | 2.0 |
① 此温度下,该反应的平衡常数K=________(注明单位).
② 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g)  2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应: CO2+CH4  CH3COOH, 请回答:
CH3COOH, 请回答:
 ① 温度与催化剂的催化效率和乙酸的生成速率如图。250~300℃时,温度升高而乙酸的生成速率降低的原因是____ _.
① 温度与催化剂的催化效率和乙酸的生成速率如图。250~300℃时,温度升高而乙酸的生成速率降低的原因是____ _.
② 为提高上述反应CH4的转化率,可采取的措施有
_ (写2种)。
③ Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为 ,每消耗3mol Cu2Al2O4时被还原的HNO3为 mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
① 若寻找吸收CO2的其他物质,下列建议合理的是___
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
② Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
A.【物质结构与性质】
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式 ▲ ,上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为 ▲ 。
(2)PO43-的空间构型是 ▲ 。
(3)与NH3互为等电子体的分子、离子有 ▲ 、 ▲ (各举一例)。
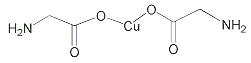
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为 ▲ 。

(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol [Cu(CN)4]2-中含有的ơ键的数目为 ▲ 。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如右图所示。则该化合物的化学式为 ▲ 。
B.【实验化学】
工业上用异丙苯氧化法合成苯酚,其生产流程如下图:

有关物质的性质如下表:
| 物质 | 沸点 | 溶解性 | 主要化学性质 |
| 异丙苯 | 152.4℃ | 不溶于水,易溶于酒精。 | 可被强氧化剂氧化 |
| 苯酚 | 181.8℃ | 微溶于冷水,易溶于热水和酒精等有机溶剂。 | 易被氧化 |
| 丙酮 | 56.2℃ | 易溶于水和有机溶剂 | 不易被氧化 |
(1)检验有机相中是否含有水的方法是 ▲ ;
(2)“操作2”的名称是 ▲ ;
(3)丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验。
| 检验项目 | 实验方案 |
| 检验丙酮中一定存在有机杂质的方法是 ▲ | A. 酸性KMnO4溶液,加热 B. 乙醇,溶解 C. NaOH溶液(酚酞),加热 |
| 检验丙酮中一定含有苯酚的方案是: | 取少许待测液置于试管中,滴加1~2滴FeCl3溶液。预期的实验现象和结论是 ▲ 。 |
(4)为测定某工厂排放的污水中苯酚的含量,进行如下实验:取污水试样10.00mL加水稀释至100mL,加入10.0mL一定浓度的KBrO3和KBr的混合溶液,立即加入5mL盐酸,摇匀后加入1gKI固体(足量),再摇匀,放置5min。用0.01000mol/LNa2S2O3标准溶液滴定至淡黄色,加入1mL淀粉溶液,继续滴定至蓝色刚好褪去,用去Na2S2O3标准溶液14.46mL。同时以水代替污水试样做对比实验,用去Na2S2O3标准溶液38.46 mL。已知上述实验中发生的反应有:
KBrO3+5KBr+6HCl=3Br2+3H2O+6KCl 2Na2S2O3+I2=Na2S4O6+2NaI
则此污水中苯酚的含量(以mg/L表示) ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体的叙述中,不正确的是( )
A.一定温度和压强下,各种气体物质体积之比等于分子数之比
B.一定温度和压强下,各种气体物质的密度之比等于摩尔质量之比
C.一定体积和温度下,各种气体物质的物质的量之比等于压强之比
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是
A.羟基的电子式: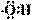
B.淀粉和纤维素的实验式:CH2O
C.CH4分子的球棍模型:
D.原子核内含有77个质子、115个中子的铱(Ir)原子:11577Ir
查看答案和解析>>
科目:高中化学 来源: 题型:
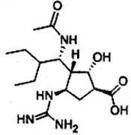
我国自主研制可治疗H7N9禽流感新药帕拉米韦,结构如图。下列有关说法正确的是
A.该有机物的分子式是C15H27O4N4
B.该分子中含有氨基、羧基、羟基、醛基等官能团
C.该分子不仅具有两性,还能发生水解反应和酯化反应
D.该分子中含有6个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
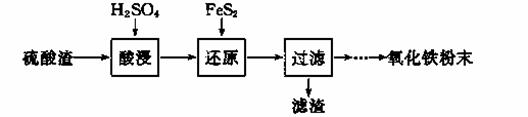
(1)“酸浸”中硫酸要适当过量,目的是 ▲ 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 ▲ 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定。有关反应的化学方程式如下:
2Fe3++Sn2++6Cl—=2Fe2++SnCl62—
Sn2++4Cl—+2HgCl2=SnCl62-+Hg2Cl2↓
6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O
滴定时,K2Cr2O7标准溶液应盛放在 ▲ 滴定管中(填“酸式”、“碱式”);若不加HgCl2,则测定的Fe3+量 ▲ (填“偏高”、“偏低”或“不变”)。
(4)①可选用 ▲ (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 ▲ (用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀硝酸、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ▲ 。
b.沉淀: ▲ 。
c.分离,洗涤。
d.烘干,研磨。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A. 在共价化合物中也可能含有离子键
B. 非金属之间形成的化学键不一定是共价键
C. 含有共价键的化合物不一定是共价化合物
D. 含有离子键的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表信息,下列叙述中正确的是
| 序号 | 氧化剂 | 还原剂 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | |
| ② | KMnO4 |
| O2 | MnO2 |
| ③ | KClO3 | 浓盐酸 | Cl2 | |
| ④ | KMnO4 | 浓盐酸 | Cl2 | MnCl2 |
A.表中①反应的氧化产物只能有FeCl3
B.表中②生成1mol的O2将有4mol的电子转移
C.表中④的离子方程式配平后,H+的化学计量数为16
D.表中③还原产物是KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com