
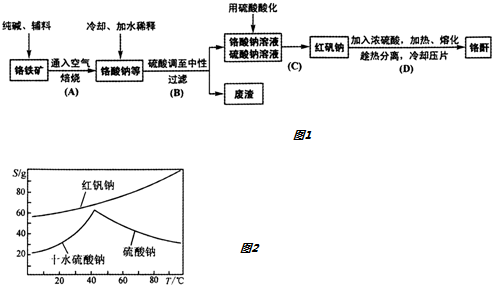
分析 工业上以铬铁矿(主要成分Fe0.Cr203,还含少量Al203),加入纯碱辅料,通入空气煅烧得到铬酸钠冷却加水稀释,加入稀硫酸调至中性过滤除去废渣,得到铬酸钠和氯酸钠混合溶液,用硫酸酸化得到红矾钠,加入浓硫酸加热熔化趁热分离得到铬酐,
(1)步骤A中主反应生成Na2Cr04的反应是Fe0.Cr203和碳酸钠、氧气发生氧化还原反应生成Na2CrO4 、2Fe2O3、CO2,结合电子守恒和原子守恒配平书写化学方程式,氧化铝是两性氧化物和碳酸钠加热反应生成偏铝酸钠和二氧化碳;
(2)碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙和二氧化硅等杂质形成炉渣除去,同时生成的二氧化碳气体会使固体原理反应完全,高温下石灰水分解产生的二氧化碳从下往上穿过炉料,使得炉料翻滚,起到搅拌作用;
(3)调节溶液中性,此时溶液中铁离子和氯离子全部沉淀;
(4)图象分析可知,分析图象中溶解度随温度的变化,操作是先分离出硫酸钠,再获得红矾钠,由图可知,硫酸钠的溶解度受温度影响比较大,温度高于50°C溶解度减小,所以应采取升温蒸发浓缩,结晶、过滤;红矾钠溶解度受温度影响变化是随温度升高增大,应采取蒸发浓缩,冷却结晶、过滤的方法得到;
(5)Cr2O72-在酸性溶液中是强氧化剂,溶液中存在化学平衡2CrO42-+2H+?Cr2O72-+H2O,酸度低平衡逆向进行.
解答 解:(1)工业铬铁矿(FeO•Cr2O3,含少量Al2O3和SiO2),加入碳酸钙和碳酸钠煅烧氧化反应FeO•Cr2O3,和碳酸钠在一起作用下发生氧化还原反应,生成氧化铁,铬酸钠和二氧化碳,反应的化学方程式为:4FeO•Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,
故答案为:4FeO•Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2;
(2)碳酸钙高温分解生成氧化钙和二氧化碳,分解产生CaO,与某些杂质反应形成炉渣,起到除杂的作用,分解产生CO2从下而上穿过,使得炉料翻滚,增大炉料与氧气的接触面积加快原料的煅烧氧化,加石灰石的主要作用是高温下石灰水分解产生的二氧化碳从下往上穿过炉料,使得炉料翻滚,起到搅拌作用,使炉料疏松,增加与氧气的接触面积有利于反应的进行,
故答案为:高温下石灰水分解产生的二氧化碳从下往上穿过炉料,使得炉料翻滚,起到搅拌作用,使炉料疏松,增加与氧气的接触面积有利于反应的进行;
(3)调节溶液中性,此时溶液中铁离子和氯离子全部沉淀,步骤B中形成废渣的主要成分是Al(OH)3、Fe(OH)3,
故答案为:Al(OH)3、Fe(OH)3;
(4)分析图象中溶解度随温度的变化,操作是先分离出硫酸钠,再获得红矾钠,由图可知,硫酸钠的溶解度受温度影响比较大,温度高于50°C溶解度减小,所以应采取升温蒸发浓缩,结晶、过滤;红矾钠溶解度受温度影响变化是随温度升高增大,应采取蒸发浓缩,冷却结晶、过滤的方法得到;步骤V操作的方法是:将Ⅳ所得溶液蒸发浓缩,趁热过滤得到硫酸钠晶体,然后将得到的滤液冷却结晶过滤得到Na2Cr2O7•2H2O,
故答案为:蒸发浓缩;Na2SO4;冷却结晶、过滤;Na2Cr2O7•2H2O;
(5)C步中用硫酸酸化,不能用盐酸酸化,因为Cr2O72-在酸性溶液中是强氧化剂,可能被盐酸还原,溶液中存在化学平衡2CrO42-+2H+?Cr2O72-+H2O,酸度低平衡逆向进行,CrO42-的转化率不高,
故答案为:Cr2O72-在酸性溶液中是强氧化剂,可能被盐酸还原,因为存在转化平衡2CrO42-+2H+?Cr2O72-+H2O,如酸度太低,CrO42-的转化率不高.
点评 本题考查了物质制备的流程分析判断,物质性质和实验操作的分析应用,把握晶体析出的原理和溶解度变化特征的分析是解题关键,题目难度中等.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CO 2分子比例模型: | B. | S 2-的结构示意图: | ||
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | D. | HCN分子的结构式:H-C≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 550℃时,若充入惰性气体,v正、v逆 均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为75.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向正反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=23.04 p总 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-4 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应时,生成2.24L氧气转移的电子数为0.2NA | |
| B. | 1L 0.1mol•L-1的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| C. | 标准状况下,2.24L三氯甲烷分子中含有共价键总数为0.4NA | |
| D. | 15g${\;}_{\;}^{14}{C}_{\;}^{16}O$和15g${\;}_{\;}^{12}{C}_{\;}^{18}O$中含有的中子数均为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉溶液中加入少量的稀硫酸,加热几分钟,冷却后再向该溶液中加入新制Cu(OH)2.没有红色沉淀生产,说明淀粉没有水解 | |
| B. | .向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去. 则使溶液褪色的气体是乙烯 | |
| C. | CO2通入到饱和的Na2CO3溶液中有晶体析出,则晶体为NaHCO3 | |
| D. | 检验Fe2+时,加入KSCN溶液后,发现溶液变红,则Fe2+已被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,1mol氦气含有的分子数为NA | |
| B. | 在常温常压下,11.2L氯气含有的分子数为0.5NA | |
| C. | 15.6gNa2O2与过量CO2反应时,转移的电子数为NA | |
| D. | 将4gNaOH溶于1L水中,可得到0.1mol/LNaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com