
【题目】下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.气态单质分子中一定存在共价键
C.含有离子键的化合物一定是离子化合物
D.含有离子键的化合物不一定是离子化合物
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,22.4LCCl4所含分子数为NA
B. 28g CO和N2的混合气体所含的原子数为NA
C. 2mol金属铁与足量的盐酸反应,共失去了 4NA个电子
D. 124g白磷(分子式为P4)所含分子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 代表阿伏加德罗常数的数值,下列说法正确的是 ( )
A. 18gH2O在标准状况下的体积是22.4L
B. 常温常压下28g以任意比组成的CO与N2混合气体中含有2NA 个原子
C. 5.6g Fe与足量盐酸反应,转移的电子数为0.3NA
D. 将0.1mol氯化钠溶于1L水中,所得溶液浓度为0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_______(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) ____________c(CH3COO-)(填“ >”或“=”或“<” )。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________。
(3) 99 ℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。此时水的离子积Kw=________,水电离出的c(H+)=________,而此时溶液中的c(Na+)__________ c(SO42-)(填“>”“=”或“<”)。
(4)相同温度下等物质的量浓度的下列溶液中
A.NH4C1 B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是__________(用对应的字母填写)。
②NH4+离子浓度由大到小的顺序是__________(用对应的字母填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法是还原沉淀法。该法的工艺流程为:
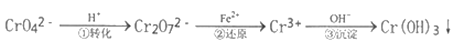
已知:CrO42-(黄色)、Cr2O72- (橙色)
(1)用离子方程式表示第①步可逆反应转化过程___________________。
(2)用离子方程式表示第②步还原反应转化过程___________________。
(3)能说明第①步反应达平衡状态的是_________。
a.Cr2O72-和CrO42-的浓度不变 b.2V(Cr2O72-) =V(CrO42-) c.溶液的颜色不变
(4)第②步中,还原1.5mol Cr2O72-离子,需要_______mol的FeSO47H2O。
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr (OH)3 (s)![]() Cr3+ (aq) +3OH- (aq)。常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-) = 10-32,要使0.01mol/Lc(Cr3+)开始沉淀,溶液的pH应调至__________,若使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________。
Cr3+ (aq) +3OH- (aq)。常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-) = 10-32,要使0.01mol/Lc(Cr3+)开始沉淀,溶液的pH应调至__________,若使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,有两种盐的稀溶液,分别是![]() mol/L NaX溶液和
mol/L NaX溶液和![]() mol/L NaY溶液,下列判断错误的是( )
mol/L NaY溶液,下列判断错误的是( )
A. 若![]() ,测得
,测得![]() ,则溶液中的
,则溶液中的![]()
B. 若![]() ,测得
,测得![]() ,则溶液中的
,则溶液中的![]()
C. 若![]() ,且
,且![]() ,则酸性:
,则酸性: ![]()
D. 若![]() ,并测得
,并测得![]() ,则HX是强酸,HY是弱酸
,则HX是强酸,HY是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某些肉类的加工过程中需要用盐渍(把较多的食盐撒在肉制品表面,腌制一段时间),以防肉类变质.其原因是
A. 食盐中的氯离子有杀菌作用
B. 由于渗透而使肉质细腻
C. 浓盐水中氧气的含量少,致使细菌无法生存
D. 由于细菌细胞膜的渗透作用使细菌失水而死亡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组依据Mg与CO2的反应。推测Mg 与SO2在隔绝空气的条件下反应后,剩余固体M可能含有MgO、S、MgS、Mg中的一种或几种。为了验证推测,进行以下实验。请回答有关问题。
实验一:按如图所示进行实验。
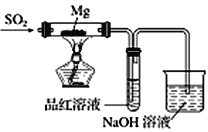
(1)实验室制取二氧化硫的化学方程式为 _________________________________。
(2)上述装置存在不合理之处,请提出一项改进建议 :___________________________。
(3)实验时,先通入SO2直到_______现象出现后,再点燃酒精灯;此操作目的是__________________。
实验二 确定固体M的成分。
实验装置如下图所示。将分液漏斗中稀硫酸(足量)加入到烧瓶中,完全反应后,实验现象如下: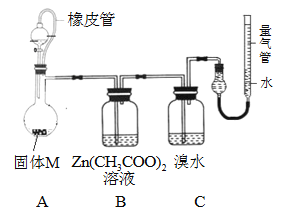
装置 | A | B | C | 量气管 |
现象 | 有残留固体 | 产生白色ZnS沉淀 | 溴水未褪色 | 进入气体v mL(标况) |
(4)实验时,B装置中反应的化学方程式为 __________________________________。
(5)已知镁的相对原子质量为24,则固体M中金属镁的质量为 _________g;实验前装置内有空气,对金属镁质量的测定结果的影响是 ____________(填“偏低”、“偏高”、“无影响”);
(6)依据以上实验,可确定固体M的成分有_________种(填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。
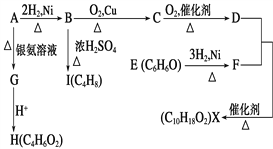
请根据上述信息回答:
(1)H中含氧官能团的名称是_______。B→C的反应类型为________B→I的反应类型为________。
(2)只用一种试剂鉴别D、E、H,该试剂是________。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为__________。
(4)D和F反应生成X的化学方程式为_______________________。
E→F的化学方程式为_______________________。
B→C的化学方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com