
| A. | 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| B. | 在标况下,22.4LHF和22.4LC2H4原子个数比为1:3 | |
| C. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 0.1 mol H2O2分子中含极性共价键数目为0.3 NA |
分析 A、求出7.2g CaO2晶体的物质的量,然后根据CaO2晶体由一个钙离子个一个过氧根构成来分析;
B、标况下HF为液体;
C、将1 mol NH4NO3溶于稀氨水中使溶液呈中性,则有:n(NH4+)+n(H+)=n(OH-)+n(Cl-);
D、双氧水中含2条极性共价键.
解答 解:A、7.2g CaO2晶体的物质的量为0.1mol,而CaO2晶体由一个钙离子个一个过氧根构成,故0.1mol过氧化钙中含0.2NA个离子,故A错误;
B、标况下HF为液体,故不能根据气体摩尔体积来计算其物质的量和原子个数,故B错误;
C、将1 mol NH4NO3溶于稀氨水中使溶液呈中性,则有:n(NH4+)+n(H+)=n(OH-)+n(Cl-),由于显中性,故n(H+)=n(OH-),则n(NH4+)=n(Cl-)=1mol,个数为NA个,故C正确;
D、双氧水中含2条极性共价键,故0.1mol双氧水中含0.2NA条极性共价键,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:A13++4NH3•H2O═4NH4++2H2O+A1O2- | |
| B. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2C12═2Fe3++Br2+4C1- | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2═Fe3++2H2O | |
| D. | 在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O═3H++2Br-+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和FeCl3溶液逐滴滴加到NaOH溶液中,即可制得Fe(OH)3胶体 | |
| B. | FeCl3溶液是电中性的,Fe(OH)3胶体是带正电荷的 | |
| C. | 可利用丁达尔现象区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 将500mL 2mol/L FeCl3溶液制成胶体,胶粒的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,故可作漂白剂 | |
| B. | Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | CaCO3在水中的溶解度很小,故CaCO3为弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
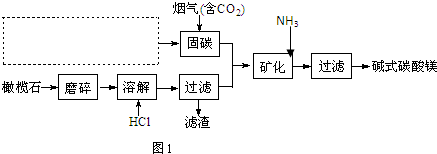
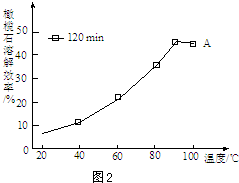
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | Al2(SO4)3═Al3++SO42- | D. | NH3•H2O═NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖原与纤维素互为同分异构体,与淀粉互为同系物 | |
| B. | 糖原能溶于水,有甜味 | |
| C. | 糖原水解的最终产物是葡萄糖 | |
| D. | 糖原具有还原性,是还原性糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
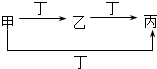 ( )
( )| 甲 | 乙 | 丙 | 丁 | |
| A | S | SO2 | SO3 | O2 |
| B | CO32- | HCO3- | CO2 | H+ |
| C | Cl2 | FeCl3 | FeCl2 | Fe |
| D | Al3+ | Al(OH)3 | AlO2- | NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com