
����Ŀ����ͼ��Ԫ�����ڱ���һ����
A | |||||||||||||||||
B | C | D | E | F | |||||||||||||
H | I | J | K | [Z | |||||||||||||
L | M | O |
��1��Ԫ��L�ļ۵����Ų�ͼΪ ��Ԫ��M��ԭ�ӽṹʾ��ͼΪ ��λ��Ԫ�����ڱ���������е� ��������Ԫ���е縺����ǿ���� ����Ԫ�ط��ű�ʾ����C��D��E��F��һ�����ܵĴ�С˳��Ϊ ����Ԫ�ط��ű�ʾ����
��2��D���⻯���J�⻯��е�ϸߵ��� ���ѧʽ�����ȶ��Ը�ǿ���� ���ѧʽ����
��3��ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ����ϱ���Ԫ��I��Ԫ��B���������������Ƶ����ʡ�д��Ԫ��B������������NaOH��Һ��Ӧ�����ӷ���ʽ ��
��4��A��E��H��J����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С������˳��Ϊ ����Ԫ�ط��ű�ʾ����E��F��H��K����Ԫ�ؼ����ӵİ뾶�ɴ�С������˳��Ϊ ����Ԫ�ط��ű�ʾ����
��5����֤��Ԫ��K��Ԫ��J�ķǽ�����ǿ����ʵ�� ������ţ���
A��������K���ʵ��ܶ�С��J���ʵ��ܶ�
B��KԪ�ص���̬�⻯���JԪ�ص���̬�⻯����ȶ�
C��K������������Ӧ�ij̶ȱ�J������������Ӧ�ij̶ȸ�����
D��KԪ�ص��������Ӧ��ˮ��������ǿ��JԪ�ص��������Ӧ��ˮ����
���𰸡���1��![]() ��2�֣���
��2�֣���![]() ��1�֣���
��1�֣���
d��1�֣���F �� F>N>O>C��2�֣�
��2��NH3��1�֣���NH3��1�֣�
��3��Be��OH��2+2OH-=BeO22-+2H2O��2�֣�
��4��Na>P>O>H��2�֣���Cl->O->F->Na+��2�֣���5��BC��2�֣�
���������������������Ԫ�����ڱ��Ľṹ��Ԫ�صķֲ�֪ʶ��֪��A��HԪ�أ�B��BeԪ�أ�C��CԪ�أ�D��NԪ�أ�E��OԪ�أ�F��FԪ�أ�HΪ��NaԪ�أ�I��AlԪ�أ�J��PԪ�أ�K��ClԪ�أ�L��VԪ�أ�M��CoԪ�ء�
��1��Ԫ��LΪV��23��Ԫ�أ�λ�ڵ������ڣ�����B����V�ļ۵����Ų�ͼΪ![]() ��Ԫ��MΪ27��Ԫ��Co��λ�ڵ������ڣ������壬ԭ�ӽṹʾ��ͼΪ
��Ԫ��MΪ27��Ԫ��Co��λ�ڵ������ڣ������壬ԭ�ӽṹʾ��ͼΪ![]() ����Ԫ��3d�ܼ��е��ӣ�λ��Ԫ�����ڱ���������е�d����Ԫ�صķǽ�����Խǿ���縺��Խǿ��������Ԫ���е縺����ǿ����F��C��D��E��F�ֱ�ΪC��N��O��F��ͬ����Ԫ�ش����ң�Ԫ�صĵ�һ������������NԪ�ص������2p�ܼ���3�����ӣ����ڰ����״̬����һ�����ܱ�����Ԫ�صĵ�һ�����ܶ������һ�����ܵĴ�С˳��ΪF>N>O>C��
����Ԫ��3d�ܼ��е��ӣ�λ��Ԫ�����ڱ���������е�d����Ԫ�صķǽ�����Խǿ���縺��Խǿ��������Ԫ���е縺����ǿ����F��C��D��E��F�ֱ�ΪC��N��O��F��ͬ����Ԫ�ش����ң�Ԫ�صĵ�һ������������NԪ�ص������2p�ܼ���3�����ӣ����ڰ����״̬����һ�����ܱ�����Ԫ�صĵ�һ�����ܶ������һ�����ܵĴ�С˳��ΪF>N>O>C��
��2��D���⻯���J�⻯��ֱ�ΪNH3��PH3���������Ӽ���������PH3���Ӽ�û����������Էе�ϸߵ���NH3���ǽ����ԣ�N>P������̬�⻯���ȶ��Ը�ǿ����NH3��
��3��Ԫ��I��Ԫ��B����������ֱ�ΪAl��OH��3��Be��OH��2�����������Ƶ����ʣ�������������NaOH��Ӧ����ƫ�����ƺ�ˮ����Be��OH��2��NaOH��Һ��Ӧ�����ӷ���ʽΪBe��OH��2+2OH-=BeO22-+2H2O��
��4��һ����˵�����Ӳ���Խ�࣬���뾶Խ��������Ų���ͬ������������Խ�࣬�뾶ԽС������A��E��H��J����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С������˳��ΪNa>P>O>H��E��F��H��K����Ԫ�ؼ����ӵİ뾶�ɴ�С������˳��ΪCl->O->F->Na+��
��5��A.�ܶ��������ʵ��������ʣ����ǽ������ǻ�ѧ���ʣ�A�����B.�ǽ�����Խǿ����̬�⻯��Խ�ȶ���KԪ�ص���̬�⻯���JԪ�ص���̬�⻯����ȶ���˵����B����ȷ��C.������������ӦԽ���ң�Ԫ�صķǽ�����Խǿ��C����ȷ��D.Ӧ����������������Ӧ������ǿ�����ȽϷǽ����Ե�ǿ����D�����ѡBC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ռ���CO2���������NaOHŨ��Һ�������ѿڷ�ա����������ޡ����ǡ����첢����ˣ�����һ����������������첢�������������й��ж���ȷ����
A�����������ޱ������ӷ�Ӧ��CO2+OH![]()
![]()
B�������������ֹ������ķ�Ӧ��Al3++3![]()
![]() Al(OH)3��+3CO2��
Al(OH)3��+3CO2��
C�����������й�������������ѧ��Ӧ���ҷ�Ӧ���������Һ�ʼ���
D������CO2��ΪNH3��ŨNaOH��Һ��Ϊˮ��������Ҳ������ȱ��ĵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֱ��ڵڶ����������ڵ�����Ԫ��A��B�����ǵ����ӵ��Ӳ�ṹ������㣬��֪A���ڵ�m�壬B���ڵ�n�壬Aֻ�������ϼۣ���A��B��ԭ�������ֱ��ǣ� ��
A.m��n
B.3��7
C.m��2��10��n
D.m+2��n+10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯīΪ�缫���������KI��Һ�����к���������̪�͵��ۣ�������˵����ȷ����
A. ����������Һ����ɫ B. ��Һ��pH���
C. �����ݳ����� D. ����������Һ����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ������Ԫ�����ڱ���λ�ã��ж�����Ԫ�ض�����Ϊ�뵼����ϵ��ǣ� ��
A.S��K
B.C��Al
C.Si��Ge
D.Ag��Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ҪʳƷ���Ӽ���ij��ѧ��ȤС����̼��Ũ����Ϊ��ʼԭ�ϣ��������װ������һ��������������Ʒ�Ӧ�Ʊ��������ơ�(�г�װ�ú�A�м���װ�����ԣ��������Ѽ���)�������ϣ���HNO2Ϊ���ᣬ�����´��ڷ�Ӧ��3HNO2��HNO3��2NO����H2O��
��NO����Ӧ���ɱ�����KMnO4��Һ����Ϊ���ᡣ
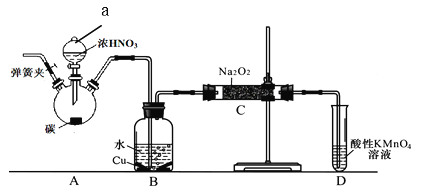
ʵ�������
���رյ��ɼУ���A�з�Һ©���������μ�һ����Ũ���ᣬ���ȣ�
��һ��ʱ���ֹͣ���ȣ�
����C��ȡ�������壬�����Ƿ����������ơ�
�ش��������⣺
(1)װ��������a������Ϊ ��A�з�Ӧ�Ļ�ѧ����ʽ�� ��
(2)Dװ�õ������� ��
(3)C�з�Ӧ����NaNO2�Ļ�ѧ����ʽ�� ��
(4)����C�в������������Ƶ���ȷ������ (�����) ��
a��ȡ��������������ϡ���ᣬ��������ɫ���岢��Һ���Ϸ���Ϊ����ɫ������NaNO2
b��ȡ��������������ˮ������μӷ�̪��Һ������Һ��죬����NaNO2
(5)������C�IJ������������ƺ������١�
����ͬѧ��ΪC�в��ﲻ�����������ƣ��������������������ʡ�Ϊ�ų����ţ�����B��Cװ�ü�����װ��E��E��ʢ�ŵ��Լ�Ӧ�� (д����)��
����ͬѧ��Ϊ���������������⣬�����п������뷴Ӧ���²�Ʒ������������ʵ�������ǰӦ����һ���������ò����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��װ���У�A��Cl2����װ�ã�C��DΪ���徻��װ�ã�E��װ��ϸͭ˿����Ӳ�ʲ����ܣ�FΪ����Ŀչ��ƿ���ձ�GΪβ������װ�á�

(1)C��װ�е��Լ��� �������� ��
(2)D��װ�е��Լ��� �������� ��
(3)��д��װ��A�з�����Ӧ�����ӷ���ʽ�� ��
��д��װ��E�з����ķ�Ӧ��ʵ������ ��
��д��װ��G�з�����Ӧ�����ӷ���ʽ�� ��
����ҵ�Ͻ�����ͨ��ʯ����[Ca(OH)2]��ȡƯ�ۣ���ѧ��Ӧ����ʽΪ ��Ư�۵���Ч�ɷ���_____________��(�ѧʽ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ƴ��˵�һ��Ԫ�����ڱ��Ŀ�ѧ���ǣ� ��
A.��������
B.��ķ��
C.����٤����
D.�Ž��з�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����������ת��

�Իش�
(1)д��B�Ļ�ѧʽ ��D�Ļ�ѧʽ ��
(2)д����Eת���F�Ļ�ѧ����ʽ ��
(3)д����KSCN����G��Һ��ʵ������ ��
(4)д����G��Һ����A���й����ӷ�Ӧ����ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com