
【题目】分别处于第二、第三周期的主族元素A和B,它们的离子电子层结构相差两层,已知A处于第m族,B处于第n族,A只有正化合价,则A、B的原子序数分别是( )
A.m、n
B.3、7
C.m﹣2、10﹣n
D.m+2、n+10
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时达到平衡,此时容器中c(NH3)=0.15mol·L-1。下列有关判断不正确的是
A.反应达平衡时N2的转化率为7.5%
B.反应进行到10s末时,H2的平均反应速率是0.0225mol·(L·s)-1
C.该反应达到平衡时的标志是容器中气体密度不再改变
D.再往该容器中充入1molN2和3molH2,重新达到平衡时c(NH3)=0.30mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2 g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0 L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0 mol/L的NaOH溶液2.8 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6 g。下列有关说法错误的是( )
A.Fe2O3与FeO的物质的量之比为1∶6
B.硝酸的物质的量浓度为3.0 mol/L
C.产生的NO在标准状况下的体积为4.48 L
D.Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度为c mol/L,体积为V mL的AgNO3溶液分别与100 mL NaCl、MgCl2、AlCl3溶液恰好完全反应,则这三种溶液的物质的量浓度之比为
A.6∶3∶2 B.1∶2∶3 C.2∶3∶6 D.2∶6∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3 。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:
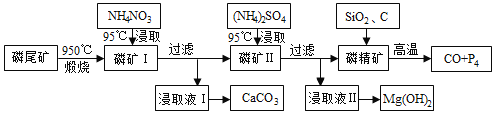
已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是__________。
(4)在浸取液II中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰干电池的总反应方程式可以表示为:Zn+2MnO2+2H2O==Zn(OH)2+2MnOOH 此电池放电时,正极上发生反应的物质是( )
A. 碳棒 B. MnO2和H2O C. Zn D. MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小,下列说法正确的是
。恒容时,温度升高,H2浓度减小,下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O![]() CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分
A | |||||||||||||||||
B | C | D | E | F | |||||||||||||
H | I | J | K | [Z | |||||||||||||
L | M | O |
(1)元素L的价电子排布图为 ,元素M的原子结构示意图为 ,位于元素周期表五个区域中的 区。上述元素中电负性最强的是 (用元素符号表示),C、D、E、F第一电离能的大小顺序为 (用元素符号表示)。
(2)D的氢化物和J氢化物沸点较高的是 (填化学式),稳定性更强的是 (填化学式)。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素I与元素B的氢氧化物有相似的性质。写出元素B的氢氧化物与NaOH溶液反应的离子方程式 。
(4)A、E、H、J四种元素的原子半径由大到小的排列顺序为 (用元素符号表示);E、F、H、K四种元素简单离子的半径由大到小的排列顺序为 (用元素符号表示)。
(5)能证明元素K比元素J的非金属性强的事实是 (填序号)。
A.常温下K单质的密度小于J单质的密度
B.K元素的气态氢化物比J元素的气态氢化物更稳定
C.K单质与氢气反应的程度比J单质与氢气反应的程度更剧烈
D.K元素的氧化物对应的水化物酸性强于J元素的氧化物对应的水化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为研究硫酸的性质,设计了以下实验。检查好装置的气密性后,在甲的试管中加入足量的Fe和少量的C,然后,加入少量浓硫酸。
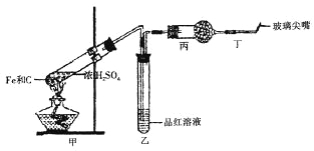
(1)在未点燃酒精灯时,乙中没有明显现象,这是因为____________;为处理生成的有毒气体,干燥管丙中应填充足量的____________。
(2)反应过程中甲中可能发生的反应为(写化学反应方程式): ____, , , 。
(3)接入该仪器后,点燃酒精灯,反应开始一段时间后,在丁处检验到某种无色无味气体,它是_______________。由于甲中加入了单质碳,使丁处产生气体的速率比不加入时快,这是因为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com