
【题目】某同学为研究硫酸的性质,设计了以下实验。检查好装置的气密性后,在甲的试管中加入足量的Fe和少量的C,然后,加入少量浓硫酸。
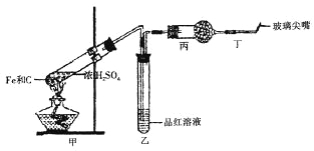
(1)在未点燃酒精灯时,乙中没有明显现象,这是因为____________;为处理生成的有毒气体,干燥管丙中应填充足量的____________。
(2)反应过程中甲中可能发生的反应为(写化学反应方程式): ____, , , 。
(3)接入该仪器后,点燃酒精灯,反应开始一段时间后,在丁处检验到某种无色无味气体,它是_______________。由于甲中加入了单质碳,使丁处产生气体的速率比不加入时快,这是因为_______________________。
【答案】(17分)(1)铁会钝化,未加热C与浓H2SO4不反应;碱石灰。(各2分)
(2)2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
Fe+Fe2(SO4)3=3FeSO4 Fe+H2SO4=FeSO4+H2↑(各2分)
(3)H2 因Fe、C与稀H2SO4构成原电池反应(各2分)
【解析】
试题分析:(1)常温下,Fe遇浓硫酸钝化,而C不与浓硫酸反应;反应有二氧化硫生成,可用碱石灰在干燥管内除掉二氧化硫;
(2)铁与浓硫酸加热反应生成硫酸铁:2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O,碳能被浓硫酸氧化为二氧化碳:C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O,碳能被浓硫酸氧化为二氧化碳:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;随反应进行,硫酸浓度变小,铁先与硫酸铁反应生成硫酸亚铁,再继续与稀硫酸反应生成氢气,反应方程式为Fe+Fe2(SO4)3=3FeSO4、Fe+H2SO4=FeSO4+H2↑;
CO2↑+2SO2↑+2H2O;随反应进行,硫酸浓度变小,铁先与硫酸铁反应生成硫酸亚铁,再继续与稀硫酸反应生成氢气,反应方程式为Fe+Fe2(SO4)3=3FeSO4、Fe+H2SO4=FeSO4+H2↑;
(3)随反应的进行,硫酸浓度变稀,铁与稀硫酸反应生成氢气,如甲中加入单质碳,铁与碳和硫酸形成原电池,原电池能加快化学反应速率。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】分别处于第二、第三周期的主族元素A和B,它们的离子电子层结构相差两层,已知A处于第m族,B处于第n族,A只有正化合价,则A、B的原子序数分别是( )
A.m、n
B.3、7
C.m﹣2、10﹣n
D.m+2、n+10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图的装置中,A是Cl2发生装置,C、D为气体净化装置,E是装有细铜丝网的硬质玻璃管,F为干燥的空广口瓶,烧杯G为尾气吸收装置。

(1)C中装有的试剂是 ,作用是 ;
(2)D中装有的试剂是 ,作用是 ;
(3)①写出装置A中发生反应的离子方程式: ,
②写出装置E中发生的反应的实验现象: ,
③写出装置G中发生反应的离子方程式: ,
④工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ,漂白粉的有效成分是_____________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池获得了广泛的使用,根据电池的电极反应,下列判断正确的是
A. Zn为负极,MnO2为正极。
B. Zn为正极,MnO2为负极。
C. 工作时电子由MnO2经外电路流向Zn极。
D. Zn电极发生还原反应,MnO2电极发生氧化反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.反应:aA(g) + bB(g) ![]() cC(g) △H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
cC(g) △H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
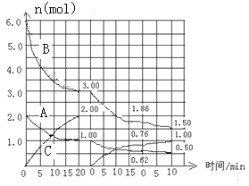
回答问题:
(1)反应的化学方程式中,a:b:c == 。
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)比较第二阶段反应温度(T2)和第三阶段反应温度(T3)的高低:T2 T3(填“>”“<”或“=”),判断的理由是 。
(4)第三阶段平衡常数K3的计算式 。
Ⅱ.利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体。

(5)B瓶中的气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化

试回答:
(1)写出B的化学式 ,D的化学式 ;
(2)写出由E转变成F的化学方程式 ;
(3)写出用KSCN鉴别G溶液的实验现象 ;
(4)写出向G溶液加入A的有关离子反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列食品添加剂与类别对应正确的一组是
A. 粉色剂——胡萝卜素、苯甲酸钠
B. 调味剂——亚硝酸钠、味精、食盐、糖
C. 防腐剂——氯化钠、山梨酸钾、糖
D. 营养强化剂——腌制肉类食品中加亚硝酸钠、粮食制品中加赖氨酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com