
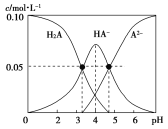
【题目】室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.10mol·L-1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法中不正确的是
A.在c(Na+)=0.10mol·L-1的溶液中:c(H2A)-c(OH-)=c(A2-)-c(H+)
B.在pH=4的溶液中, c(HA-)=c(A2-) + c(H2A)
C.在pH=7的溶液中:c(Na+)=2c(A2-)
D.K1(H2A)的数量级约为10-3.3
【答案】B
【解析】
A.c(Na+)=0.10mol/L的溶液中为NaHA溶液,溶液中存在电荷守恒(H+)+c(Na+)=2c(A2-)+c(HA-)+c(OH-),物料守恒c(Na+)=c(A2-)+c(HA-)+c(H2A),代入计算得到c(H+)+c(H2A)=c(OH-)+c(A2-),故A正确;
B.依据图象可知pH=4的溶液中,c(HA-)>c(A2-)+c(H2A),故B错误;
C.室温时,Kw=1×10-14,pH=7的溶液中,显中性,(H+)=c(OH-),根据电荷守恒c(H+)+c(Na+)=2c(A2-)+c(OH-),所以c(Na+)=2c(A2-),故C 正确;
D. 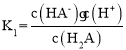 ,根据图像可知pH约为3.3时,c(H2A)= c(HA-),则
,根据图像可知pH约为3.3时,c(H2A)= c(HA-),则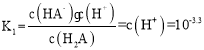 ,故D正确;
,故D正确;
故答案为B。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】为纪念元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家提名,形成一张“青年化学家元素周期表”,向世界介绍118位优秀青年化学家,有8位中国青年化学家成为“N、Hg、U”等元素的代言人。回答下列问题:
(1)N在周期表中的位置是__。
(2)下列有关性质的比较,能用元素周期律解释的是__。
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:Na2CO3>NaHCO3
(3)非金属性:Cl>Br,用原子结构解释原因__,用一个离子方程式证明__。
(4)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。
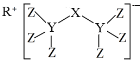
①Y的元素符号为__。②X的氢化物的电子式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)现有下列几组物质,请将其字母按要求填入空格内:
A.CH2=CH—COOH和油酸(C17H33COOH)
B.乙醇和乙二醇
C.丙醇和甲苯
D.![]() 和
和![]()
① 互为同系物的是___________ 。
② 互为同分异构体的是___________ 。
③ 既不是同系物,也不是同分异构体,但可看成是同一类有机物的是___________ 。
(2)现有下列物质,请将其字母按要求填入空格内:
A.淀粉 B.葡萄糖(C6H12O6) C.某些蛋白质 D.油脂
① 遇I2变蓝的是___________。
② 遇浓HNO3呈黄色的是___________。
③ 能发生皂化反应制取肥皂的是___________。
④ 加热条件下能与新制的氢氧化铜反应生成红色沉淀的是___________ 。该物质若发生银镜反应,每3.6g可产生银单质的量是_______。(从下列选项中选出正确答案,并将字母填在空格内)
A. 4.32 g B.8.64g C.0.02mol D.0.06 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素可以组成一种分子簇,其分子结构如图所示,(球大小表示原子半径的相对大小),W、X位于不同周期,X原子的最外层电子数是次外层电子数的3倍,Z的族序数等于其周期数,下列说法中正确的是
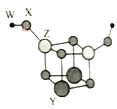
A.Y、Z的简单离子均不影响水的电离平衡
B.工业上获得Y、Z单质均可采用电解它们的熔融氯化物
C.Y的最高价氧化物对应水化物的碱性比Z的弱
D.相同条件下,W单质的沸点比X单质的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______。
(4)A、C、D、E的原子半径由大到小的顺序是_______(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______于F(填“强”或“弱”),并用化学方程式证明上述结论_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学---选修3:物质结构与性质)“可燃冰”是蕴藏于海底的一种潜在能源。它由盛有甲烷、氮气、氧气、硫化氢等分子的水分子笼构成。
(1)水分子间通过______相互结合构成水分子笼。N、O、S元素第一电离能由大到小的顺序为________(填元素符号)。
(2)从海底取得的“多金属结核”样本,样本中含铁、锰等多种金属。
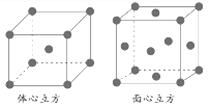
①基态铬原子的电子排布式为________________。
②金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
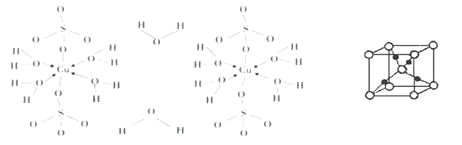
①写出基态Cu2+的核外电子排布式_______。
②胆矾中含有的粒子间作用力是_______(填序号)。
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
③在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1 mol CN-中π键的数目为_______。
胆矾受热分解得到铜的某种氧化物,其晶胞结构如上图所示,则氧的配位数是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com