
| A. | 该物质作净水处理剂与Cl2的作用原理完全相同 | |
| B. | 该反应表明碱性条件下ClO-氧化性强于FeO42- | |
| C. | 上述反应中Fe(0H)3与ClO-的物质的量之比应为3:2 | |
| D. | 因为FeO32-可直接水解生成氢氧化铁胶体,故可做自来水的聚凝剂 |
分析 Fe(OH)3+ClO-+OH-→FeO42-+Cl-+H2O中,Fe元素的化合价由+3价升高为+6价,Cl元素的化合价由+1价降低为-1价,由电子守恒和原子守恒可知,该反应为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,以此来解答.
解答 解:由电子守恒和原子守恒可知,该反应为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
A.K2FeO4处理水时,+6价铁为最高价,具有强氧化性能消毒杀菌,而且还原产生的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质,而氯气只能杀菌消毒,所以原理不完全相同,故A错误;
B.由反应可知,氧化剂的氧化性强于氧化产物,所以碱性条件下ClO-氧化性强于FeO42-,故B正确;
C.Cl元素的化化合价降低,Fe元素的化合价升高,则由反应可知还原剂Fe(0H)3和氧化剂ClO-的物质的量之比为2:3,故C错误;
D.K2FeO4处理水时,+6价铁为最高价,具有强氧化性能消毒杀菌,而且还原产生的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质,不可直接水解生成氢氧化铁胶体,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及电子守恒、原子守恒的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 房屋装修所用装饰材料释放出的甲醛、苯、氨等气体对人体无害,不会造成污染 | |
| B. | 食品包装袋小包内盛有装氧化钙或生石灰用作食品的抗氧化剂 | |
| C. | 制作航天服的聚酯纤维和“天宫一号”中使用的碳纤维都是新型无机非金属材料 | |
| D. | 绿色化学的核心就是利用化学原理从源头减少和消除工业对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3溶液 | ||
| C. | 加AgNO3溶液前未用稀硝酸酸化 | D. | 反应后的溶液中不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、CO2、HCl | B. | H2、Cl2、H2S | C. | NH3、O2、H2 | D. | CO2、H2S、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)( mol•L-1) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)( mol•L-1) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | c | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

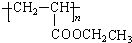 .
. .
. 与
与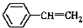 也可以发生类似反应①的反应,其有机产物的结构简式为:
也可以发生类似反应①的反应,其有机产物的结构简式为: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Br-CH2-CH2Br | B. | CH3-CHBr-CH3 | C. | CH3-CH2-CHBr2 | D. | CH3-CHBr-CH2Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com