
分析 依据化学方程式结合三段式列式计算,设A、B的物质的量为nmol;C的平均反应速率是0.1mol/(L•min),生成C的物质的量=0.1mol/(L•min)×2L×5min=1mol;
D的浓度为0.5mol/L,所以D的物质的量为0.5mol/L×2L=1mol.
3A(g)+B(g)=xC(g)+2D(g),
开始(mol) n n 0 0
反应(mol) 1.5 0.5 0.5x 1
5min(mol)(n-1.5)( n-0.5)0.5x 1
c(A):c(B)=$\frac{(n-1.5)mol}{2L}$:$\frac{(n-0.5)mol}{2L}$=3:5,
解得:n=3,x=2;
再根据反应速率V=$\frac{△c}{△t}$进行计算.
解答 解:设A、B的物质的量为nmol;C的平均反应速率是0.1mol/(L•min),生成C的物质的量=0.1mol/(L•min)×2L×5min=1mol;
D的浓度为0.5mol/L,所以D的物质的量为0.5mol/L×2L=1mol.
3A(g)+B(g)=xC(g)+2D(g),
开始(mol) n n 0 0
反应(mol) 1.5 0.5 0.5x 1
5min(mol)(n-1.5)( n-0.5)0.5x 1
c(A):c(B)=$\frac{(n-1.5)mol}{2L}$:$\frac{(n-0.5)mol}{2L}$=3:5,
解得:n=3,x=2;
(1)5min后A的浓度c(A)=$\frac{(3-1.5)mol}{2L}$=0.75mol•L-1,反应开始前容器中的A、B的物质的量:n(A)=n(B)=3mol,
故答案为:0.75;3;
(2)B的平均反应速率:V(B)=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L•min),
故答案为:0.05;
(3)x的值为2,
故答案为:2.
点评 本题考查化学反应速率的相关计算,难度中等.平衡三段式的正确使用时解题的关键.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
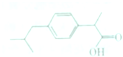 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )| A. | 布洛芬的分子式为C12H18O3 | |
| B. | 布洛芬与苯甲酸(C6H5COOH)互为同系物 | |
| C. | 布洛芬能发生加成、取代等反应 | |
| D. | 丁苯丙酸共有12种可能的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖与蔗糖 | |
| B. | O2和O3 | |
| C. | $\left.\begin{array}{l}{12}\\{6}\end{array}\right.$C与$\left.\begin{array}{l}{13}\\{6}\end{array}\right.$C | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质作净水处理剂与Cl2的作用原理完全相同 | |
| B. | 该反应表明碱性条件下ClO-氧化性强于FeO42- | |
| C. | 上述反应中Fe(0H)3与ClO-的物质的量之比应为3:2 | |
| D. | 因为FeO32-可直接水解生成氢氧化铁胶体,故可做自来水的聚凝剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338 | 1.84 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com