
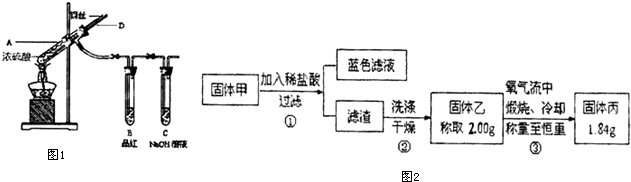
分析 (1)装置A中铜与浓硫酸反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)导管D起到了平衡A中大气压的作用,当熄灭酒精灯后,空气从导管D中进入,使试管中压强与大气压相等;
(3)从D管口向A中大量鼓气可使装置中残留气体完全被吸收;
(4)检验滤渣是否洗涤干净的实验方法是取最后一次洗涤后所得液体少许于试管中,滴加硝酸银溶液观察是否有沉淀生成;
(5)根据反应:Cu+O2=CuO;Cu2S+2O2=2CuO+2SO2;2CuS+3O2=2CuO+2SO2;从质量变化的角度分析.
解答 解:(1)装置A中铜与浓硫酸反应生成二氧化硫气体,反应的化学方程式为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;SO2+2OH-=SO32-+H2O;
(2)熄灭酒精灯后,试管A中气体压强减小,空气从D导管进入试管A中,从而使A中压强与大气压相等,所以B中的液体不会倒吸,
故答案为:试管A中气体压强减小,空气从D导管进入试管A中;
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是从D管口向A中大量鼓气,
故答案为:从D管口向A中通入空气(鼓气);
(4)检验滤渣是否洗涤干净的实验方法是取最后一次洗涤后所得液体少许于试管中,滴加硝酸银溶液,若无白色沉淀产生,则说明沉淀洗涤干净,若有白色沉淀生成,则说明未洗干净,
故答案为:取最后一次洗涤后所得液体,滴加硝酸银溶液,若无白色沉淀产生,则说明沉淀洗涤干净,若有白色沉淀生成,则说明未洗干净;
(5)根据反应判断:Cu+O2=CuO 反应后固体质量增重,Cu2S+2O2=2CuO+2SO2反应后固体质量不变,2CuS+3O2=2CuO+2SO2反应后固体质量减重,则一定存在的反应为:2CuS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2,
故答案为:2CuS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2.
点评 本题考查浓硫酸的性质,题目难度中等,试题整合和拓展了教材中的典型实验,侧重基本实验操作能力考查,注意掌握常见气体的制备、除杂、收集、尾气处理等基本操作,熟悉教材中的典型实验装置.


科目:高中化学 来源: 题型:解答题
 A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:
A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:| 元素 | 相关信息 |
| A | 元素A是周期表中原子半径最小的元素 |
| B | B的单质由双原子分子构成,分子中有14个电子 |
| C | C3单质在大气层的平流层中,其浓度的减少会导致人患皮肤癌 |
| D | D是前四周期元素中第一电离能最小的元素 |
| E | E位于ds区且原子的最外层电子数与A相同 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验目的 | 实验设计 |
| A | 证明CH2═CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| B | 鉴别碳酸钠溶液与碳酸氢钠溶液 | 分别加入少量的氢氧化钠溶液,观察现象 |
| C | 实验室制取少量O2气体 | 将蒸馏水滴入过氧化钠固体中,用排水法收集产生的气体 |
| D | 除去硫酸铜溶液中少量的硫酸铁 | 加入过量铜粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
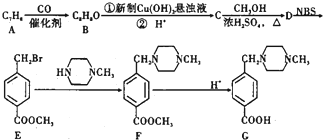

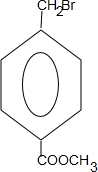 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$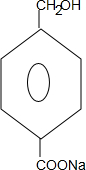 +CH3OH+NaBr
+CH3OH+NaBr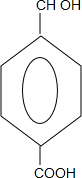 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$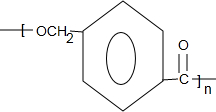 +nH2O
+nH2O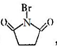 ,则关于NBS与D反应生成E的 说法错误的是 ( )
,则关于NBS与D反应生成E的 说法错误的是 ( )查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)( mol•L-1) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)( mol•L-1) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | c | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铯碱性强于氢氧化钠 | |
| B. | 碱金属单质从Li到Cs,熔点依次升高 | |
| C. | 碱金属单质均为银白色,从Li到Cs,密度逐渐增大 | |
| D. | 碱金属元素形成的阳离子,从Li+到Cs+,氧化性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、丙醇 | B. | 乙醇、乙二醇 | C. | 1-丙醇、2-丙醇 | D. | 乙烯、乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com