
| A. | 乙醇、丙醇 | B. | 乙醇、乙二醇 | C. | 1-丙醇、2-丙醇 | D. | 乙烯、乙烷 |
分析 两种物质以任意质量比混合,如混合物的质量一定,充分燃烧时产生的二氧化碳的量是定值,根据碳元素守恒,则混合物各组分中碳元素质量分数相等.
解答 解:两种物质以任意质量比混合,如混合物的质量一定,充分燃烧时产生的二氧化碳的量是定值,根据碳元素守恒,则混合物各组分中碳元素质量分数相等,
A.乙醇为C2H6O,与C3H9O1.5中碳元素质量分数相等,而丙醇为C3H8O,乙醇与丙醇中碳元素质量分数不相等,故A错误;
B.乙醇为C2H6O,乙二醇为C2H6O2,二者碳元素质量分数不相等,故B错误;
C.1-丙醇、2-丙醇分子式均为C3H8O,二者碳元素质量分数相等,故C正确;
D.乙烯、乙烷的最简式不同,二者碳元素质量分数不相等,故D错误,
故选C.
点评 本题考查混合物计算,注意利用碳元素守恒判断混合物各组分中碳元素质量分数相等,侧重考查学生分析计算能力,难度中等.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
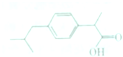 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )| A. | 布洛芬的分子式为C12H18O3 | |
| B. | 布洛芬与苯甲酸(C6H5COOH)互为同系物 | |
| C. | 布洛芬能发生加成、取代等反应 | |
| D. | 丁苯丙酸共有12种可能的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
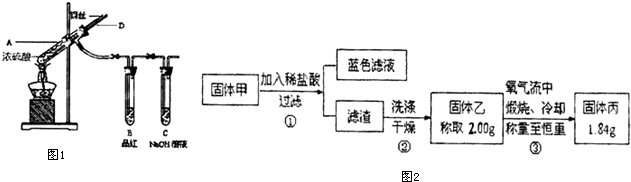
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
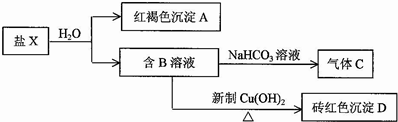
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层只有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素一定是金属元素 | |
| D. | 核电荷数为17的元素的原子的质量数一定是35 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.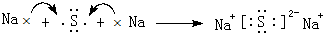 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2═HCOONa+H2O.储氢、释氢过程均无能量变化 | |
| B. | 2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的热效应相同 | |
| C. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 | |
| D. | 过程N2(g)-→2N(g)放出能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com