
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.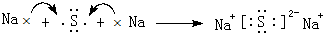 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. .
. 分析 根据元素在周期表中的位置判断元素的种类,利用元素周期律的递变规律推断元素的性质、对应单质和化合物的性质以及结构的相似性和递变性解答该题.
(1)稀有气体的性质稳定;
(2)元素的非金属性越强,其对应的最高价氧化物的水化物的酸性越强,元素的金属性越强,则对应的最高价氧化物的水合物的碱性越强;
(3)氧化铝是两性氧化物,可以和碱之间反应生成盐和水;
(4)④与⑥形成的化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成;
(5)根据共价化合物的电子式的书写知识来回答,不同元素的原子间形成的共价键是极性共价键.
解答 解:根据元素在周期表中的分布,①~⑨元素分别是:C、N、O、Na、Al、S、Cl、Ar、K.
(1)稀有气体的性质稳定,所以在这些元素中,化学性质最不活泼的是Ar,故答案为:Ar;
(2)元素的非金属性越强,其对应的最高价氧化物的水化物的酸性越强,最高价氧化物的水化物的酸性最强的化合物应是HClO4,元素的金属性越强,则对应的最高价氧化物的水合物的碱性越强,在以上元素中,金属性最强的元素为K元素,对应的KOH的碱性最强,其电子式为 ,
,
故答案为:HClO4; ;
;
(3)Al的氧化铝是两性氧化物,可以和碱氢氧化钠之间反应生成偏铝酸钠和水,离子反应为Al2O3+2OH-=AlO2-+2H2O,
故答案为:Al;Al2O3+2OH-=AlO2-+2H2O;
(4)④与⑥形成的化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成过程为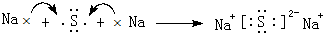 ,该化合物属于离子化合物,
,该化合物属于离子化合物,
故答案为: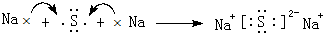 ;离子;
;离子;
(5)C和Cl形成的化合物中只有共价键,电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查元素周期表与元素周期律的关系,元素的位置、结构和性质的推断,题目难度不大,注意元素周期律的递变规律等知识的积累.


科目:高中化学 来源: 题型:选择题
| 序号 | 实验目的 | 实验设计 |
| A | 证明CH2═CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| B | 鉴别碳酸钠溶液与碳酸氢钠溶液 | 分别加入少量的氢氧化钠溶液,观察现象 |
| C | 实验室制取少量O2气体 | 将蒸馏水滴入过氧化钠固体中,用排水法收集产生的气体 |
| D | 除去硫酸铜溶液中少量的硫酸铁 | 加入过量铜粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铯碱性强于氢氧化钠 | |
| B. | 碱金属单质从Li到Cs,熔点依次升高 | |
| C. | 碱金属单质均为银白色,从Li到Cs,密度逐渐增大 | |
| D. | 碱金属元素形成的阳离子,从Li+到Cs+,氧化性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、丙醇 | B. | 乙醇、乙二醇 | C. | 1-丙醇、2-丙醇 | D. | 乙烯、乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、CO2 | B. | MgF2、H2O2 | C. | NaOH、Ba(OH)2 | D. | NaCl、KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH3CH=CHCH3 | ||
| C. | CH3COOH和HCOOCH3 | D. | CH3CH2CHO和CH3COCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或 或CH2=CHCH2OH.
或CH2=CHCH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
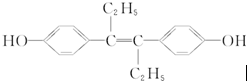
| A. | 它易溶于有机溶剂 | |
| B. | 可与NaOH和Na2CO3溶液发生反应 | |
| C. | 该有机物分子中一定有14个碳原子共平面 | |
| D. | 1 mol该有机物可与5 mol Br2发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com