
【题目】下列反应中,硫元素表现出还原性的是( )
A. 稀硫酸与锌粒反应 B. 亚硫酸与氧气反应
C. 浓硫酸与炭反应 D. Na2SO3固体与浓H2SO4反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如下图所示。
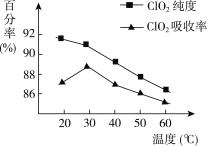
请回答下列问题:
(1)据图可知,反应时需要控制的适宜温度是________ ℃,达到此要求采取的适宜措施是________。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量的说法中正确的是( )
A.物质的量是人们主观规定的基本物理量之一
B.物质的量实质上就是物质的质量
C.物质的量是人们根据其他的物理量推导出来的新的物理量
D.物质的量是一种物理量的单位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在宏观—微观—符号之间建立联系,是化学学科特有的思维方式。汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”便可以使汽车的尾气转换成无毒气体。如用●表示碳原子,用○表示氧原子,用![]() 表示氮原子,下图为气体转换的微观过程。请根据图示回答下列问题:
表示氮原子,下图为气体转换的微观过程。请根据图示回答下列问题:
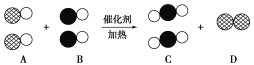
(1)A、B、C三种物质可以归为一类的依据是_________________________________
(2)将C归为化合物,将D归为单质的理由是_______________。
(3)图示反应用化学反应方程式表示为_________化学变化过程中消耗的A物质和生成的C物质的质量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫及其化合物的叙述正确的是( )
A. 硫单质是一种淡黄色易溶于水的固体
B. SO2具有漂白性,可用于食品的漂白
C. 用作“钡餐”的物质主要成分是硫酸钡
D. 可用澄清石灰水鉴别SO2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨(74W)是熔点最高的金属,是重要的战略物资。自然界中钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。由黑钨矿冶炼钨的工艺流程如下:

已知:①滤渣I的主要成份是Fe2O3、MnO2。②上述流程中,除最后一步外,其余步骤钨的化合价未变。③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸中钨元素的化合价为_________,写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式___________________________________________。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为_______________________________。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。则T1________T2(填“>”或“<”)。
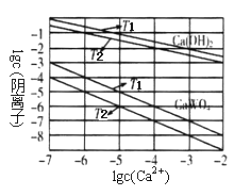
将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为_________________,T2时该反应的平衡常数为_________________。
(4)硬质合金刀具中含碳化钨(WC),利用电解法可以从碳化钨废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸并放出CO2。该阳极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的ⅥB族,F的基态原子中有4个未成对电子。
(1)A元素单质的结构式为___________;B元素原子中的未成对电子数为_______________________。
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是______;A与B形成的AB2-的空间构型为___________________________。
(3)A、B、C三种元素的第一电离能从大到小的顺序为_______________(用元素符号表示)。
(4)基态F3+的核外电子排布式是_____________________;F3+与SCN-络合得到多种配合物,其中配位数为5的配合物的化学式为__________________;化合物FD3是棕色固体、易潮解,100℃左右时升华,FD3的晶体类型是__________________________。
(5)铁在不同温度范围有不同的晶体结构。室温下铁是简单立方,称为α铁(α-Fe)。当温度升高到912℃,α铁转变为面心立方,称为γ铁(γ-Fe)。当温度继续升高到1394 ℃,γ铁转变为体心立方。称为δ铁(δ-Fe)。

①γ铁晶体中铁原子配位数是____________________。
②δ铁晶体密度为dg·cm-3,则其晶胞参数(边长)为__________cm(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Q是一种治疗关节炎的止痛药,合成Q的路线如下:

(1)A的名称为__________,D中含有的官能团名称为__________
(2)E→F的反应类型为__________,G→M的反应类型为__________
(3)B与(ClCH2CO)2O反应生成C和另一有机物H,该反应的化学方程式为__________
(4)有机物J为M的同分异构体。J有多种结构,写出两种满足下列条件的J的结构简式__________。
①苯环上只有两个取代基
②能发生银镜反应
③核磁共振氢谱图中只有5组吸收峰,且峰面积之比为9:2:2:2:1
④酸性条件下能发生水解反应,且水解产物之一能与氯化铁溶液发生显色反应
(5)请写出以1-丙烯、苯、乙酸酐[(CH3CO)2O]为原料根据A→C和M→Q的反应合成 的路线流程图(无机试剂任用,合成路线流程图示例见本题题干):__________
的路线流程图(无机试剂任用,合成路线流程图示例见本题题干):__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程如下:

已知:①Fe3+、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含铜32 g·L-1的硫酸铜溶液1.0 L,需要称量冶炼级硫酸铜的质量至少为___________g。
(2)测定溶解液中的Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用
________(“酸式”或“碱式”)滴定管,其中反应离子方程式为:______________________。若要检验调节pH后溶液中的Fe3+已除尽的方法是___________________________。
(3)氧化后需要将溶液进行稀释及调节溶液的pH=5,则稀释后的溶液中铜离子浓度最大不能超过____________mol·L-1。
(4)固体Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外还有__________________,由溶液Ⅰ获得CuSO4·H2O,需要经过________ 、____________、过滤、洗涤、干燥操作。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含锌、银、铂杂质)制备纯铜,写出阳极发生的电极反应式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com