
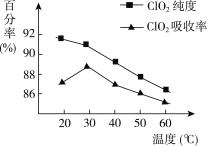
【题目】以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如下图所示。
请回答下列问题:
(1)据图可知,反应时需要控制的适宜温度是________ ℃,达到此要求采取的适宜措施是________。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式:____________________________________。
【答案】30水浴加热(或水浴控制恒温)15ClO3-+FeS2+14H+=15ClO2↑+Fe3++7H2O+2SO42-
【解析】
(1)依据图象分析温度再30°C时ClO2的吸收率最大纯度90%以上;控制100°C以下的 温度需要用水浴加热;
(2)用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,依据原子守恒,电子守恒和电荷守恒配平书写离子方程式;
(1)ClO2气体的纯度,且会影响ClO2的吸收率,依据图象分析温度再30°C时ClO2的吸收率最大纯度90%以上,控制100°C以下的温度需要用水浴加热;
(2)用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,氯酸跟离子在酸溶液中具有强氧化性,氧化FeS2为硫酸铁和硫酸,本身被还原为反应的离子方程式为ClO2;结合原子守恒、电子守恒配平写出离子方程式为:15ClO3-+FeS2+14H+═15ClO2+Fe3++7H2O+2SO42-;


科目:高中化学 来源: 题型:
【题目】科学家使用普通氧分子和带正电的氧离子可以制造出一种含有四个氧原子的新型氧分子,利用质谱仪探测可以证实它的存在。你认为下列说法正确的是
A.该分子带2个单位正电荷
B.该分子构成的物质与臭氧是同一种物质
C.该分子是一种新的氧化物分子
D.该物质与氧气、臭氧互称为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.氯气是黄绿色、有刺激性气味、有毒的气体
B.三氧化二铝是两性氧化物
C.晶体硅用来制作光导纤维
D.焰色反应是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
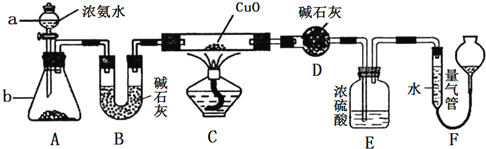
【题目】某课外活动小组同学欲利用CuO与NH3的反应来研究NH3的某种性质并测定其组成,设计的实验装置如图所示(夹持装置已省略)。
请回答下列问题:
(1)仪器a的名称为______________;仪器b中盛装的试剂为__________________(填名称)。
(2)实验中观察到装置C中黑色CuO粉末变为单质铜,且量气管中有气体单质产生,上述实验现象证明NH3具有____________性,写出相应的化学方程式:_________________________。
(3)装置E中浓硫酸的作用是_________________________________。
(4)实验结束后,若测得干燥管D增重mg,装置F中气体的体积为nL(已折算为标准状况),则氨分子中氮、氢的原子个数比为___________(用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,我国某物理研究所取得重大科技成果,研制出由18O所构成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是
A. 1.8 g 18O2的物质的量是0.05 mol
B. 0.1 mol H218O中所含的中子数约为6.02×1023
C. 0.2 mol 18O2的体积约为4.48 L
D. 18O2的摩尔质量为36 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分別取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液変红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够谨慎,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________。
(4)丙组同学取10mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分別取2mL此溶液于3支武管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_______(填离子符号);实验①和实验③说明:在I-过量的情况下,溶液中仍含有_____(填离子符号);由此可以证明该氧化还原反应为___________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________。一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是__________。生成沉淀的原因是______________(用平衡移动原理解释)。
(6)某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液通入标准状况下112mLCl2,恰好将Fe2+完全氧化,则x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质的分类、名称(俗名)、化学式都正确的是( )
A.碱性氧化物 氧化铁 FeOB.酸 硫酸 H2S
C.酸性氧化物 干冰 CO2(固态)D.盐 石膏 2CaSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊(Tl)是某超导材料的组成元素之一,已知铊位于第六周期ⅢA族。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag![]() Tl++2Ag+。下列推断正确的是
Tl++2Ag+。下列推断正确的是
A. Tl+最外层有1个电子
B. Tl3+的氧化性比Ag+弱
C. Tl能形成+3价和+1价的化合物
D. Tl+的还原性比Ag强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,硫元素表现出还原性的是( )
A. 稀硫酸与锌粒反应 B. 亚硫酸与氧气反应
C. 浓硫酸与炭反应 D. Na2SO3固体与浓H2SO4反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com