
【题目】今有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B. 分别加水稀释10倍,四种溶液的pH ①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D. VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb=11∶9
【答案】C
【解析】试题分析:A.①、②中分别加入适量的氯化铵晶体后,前者电离被抑制,后者消耗氢氧根,因此两溶液的pH均减小,A正确;B.强酸、强碱稀释10倍,pH变化1,则稀释10倍时②的pH=9,④的pH=5,而弱酸、弱碱稀释10倍,pH变化小于1,则①的9<pH<10,③的4<pH<5,即分别加水稀释10倍四种溶液的pH为①>②>④>③,B正确;C.①、④两溶液等体积混合,溶液中氨水过量,溶质为氯化铵和一水合氨,溶液显碱性,氨水的电离大于铵根离子的水解,则c(NH4+)>c(Cl-)>c(OH-)>c(H+),C错误;D.若混合后溶液pH=4,则盐酸过量,则![]() ,解得Va:Vb=11:9,D正确,答案选C。
,解得Va:Vb=11:9,D正确,答案选C。


科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1
B. pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<①
C. 某温度Ksp(Ag2S)=6×10-50, Ksp(AgCl)=2×10-6, 则 2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×1037
Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×1037
D. 一定浓度的 NaHS 溶液中:c(Na+)+c(OH-)==c(H+)+c(HS-)+2c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色透明溶液,取出少量滴入氯化钡溶液,只有白色沉淀生成;另取一定体积的无色溶液加入过量过氧化钠,有无色无味气体产生,同时有白色沉淀生成,其沉淀量与加入过氧化钠的量关系如图所示,则①H+②NH4+③Al3+④Mg2+⑤Fe2+⑥NO3-⑦SO42-⑧CO32-中一定存在的离子是

A. ③④⑧ B. ③④⑦ C. ②③④⑧ D. ①③④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别将下列物质:①FeCl3 ②KMnO4 ③NaCl ④Ca(HCO3)2 ⑤Na2SO3 ⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干灼烧,能得到原物质的是( )
A. ②③ B. ③⑥ C. ①④ D. ⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关该有机物的说法不正确的是

①分子式为C10H18O3
②易溶于水
③分子中含有两种官能团
④可使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同
⑤能发生加成、取代、酯化、消去、催化氧化等反应
⑥所有的原子可能共平面
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质分子在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中不正确的是
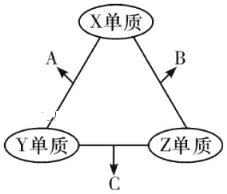
A. X与Z形成的某种化合物可用来杀菌消毒 B. C极易溶于B中,溶液呈碱性
C. Y与Z形成的二元化合物只含有极性键 D. A和C能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=10的X、Y两种碱溶液各1mL,分别加水稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )

A. 稀释前,两种碱溶液中溶质的物质的量浓度一定相等
B. 稀释后,X溶液的碱性比Y溶液的碱性强
C. 完全中和X、Y溶液时,消耗同浓度盐酸的体积VX>VY
D. 若8<a<10,则X、Y都是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究难溶电解质的沉淀溶解平衡及在生产生活中应用意义重大。
(1)FeS沉淀废水中的Hg2+的反应式为:_________________;
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2 (s)![]() Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)c2(OH-)=2×10-20mol2L-2;
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)c2(OH-)=2×10-20mol2L-2;
①某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于_____;
②要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液中OH-浓度为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com