
����Ŀ����10��)������֬���̻���Ĥ����Ĥ���й�������ԣ�������ǿ�����������õ���ĥ�Ժ;�Ե�Ե����ܣ�������һ�ִ�����֬M�ĺϳ�·�ߣ�

��֪�����л���C�ĺ˴Ź���������ʾֻ�����ֲ�ͬ��ѧ��������
��
��Ҫ��ش����⣺
(1)F�й����ŵ�����Ϊ_______����֪���������ķ�Ӧ����Ϊ_______
(2)B�Ľṹ��ʽΪ_______��
(3)д��C+F��M�Ļ�ѧ����ʽ��_______��
(4)�������������� ͬ���칹����______�֡�
ͬ���칹����______�֡�
A������Ũ��ˮ��Ӧ������ɫ��������1mol�����ʿ�����2molBr2
b���ܷ�����ȥ��Ӧ
(5)����Լ�ȩ�ͱ�ȩΪԭ���Ʊ�![]() �ĺϳ�·��(������ͼ��ʾ�����Լ���ѡ)ע���ϳ�·�ߵ���д��ʽ��������ʵ����
�ĺϳ�·��(������ͼ��ʾ�����Լ���ѡ)ע���ϳ�·�ߵ���д��ʽ��������ʵ����
![]()
���𰸡�(1)�Ȼ����ӳɷ�Ӧ(��1��)��(2)  (2��)��
(2��)��
(3) 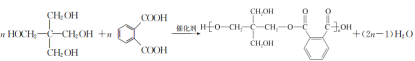 (2��)
(2��)
(4)4(2��)��(5)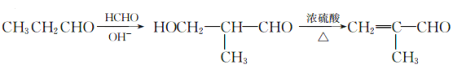 (2��)
(2��)
��������
�����������ȩ����ȩ������Ϣ���ķ�Ӧ����B��B�����������ӳɷ�Ӧ����C������C�ķ���ʽ��֪B�Ľṹ��ʽΪ(HOCH2)3C��CHO�����C�Ľṹ��ʽΪ(HOCH2)4C�����ǻ���������������ȩ������E�Ľṹ��ʽΪ![]() ��E������������ͭ����Һ��Ӧ���ữ������F����F�Ľṹ��ʽΪ
��E������������ͭ����Һ��Ӧ���ữ������F����F�Ľṹ��ʽΪ ��F��C�������۷�Ӧ����M������M�Ľṹ��ʽΪ
��F��C�������۷�Ӧ����M������M�Ľṹ��ʽΪ ��
��
(1)�������Ϸ�����֪F�й����ŵ�����Ϊ�Ȼ�����֪���������ķ�Ӧ����Ϊ�ӳɷ�Ӧ��
(2)�������Ϸ�����֪B�Ľṹ��ʽΪ ��
��
(3)�������Ϸ�����֪C+F��M�Ļ�ѧ����ʽΪ ��
��
(4) A������Ũ��ˮ��Ӧ������ɫ��������1mol�����ʿ�����2molBr2��˵�����з��ǻ����ҷ��ǻ�����λ���λ���ƺ���2����ԭ�ӣ�b���ܷ�����ȥ��Ӧ��˵�������д��ǻ������Ϻ��У�OH�ͣ�CH2CH2OH��OH�ͣ�CHOHCH3����λ�þ�����λ���λ��������4��ͬ���칹�塣
(5)������֪��Ϣ����֪�Լ�ȩ�ͱ�ȩΪԭ���Ʊ�![]() �ĺϳ�·�߿ɱ�ʾΪ
�ĺϳ�·�߿ɱ�ʾΪ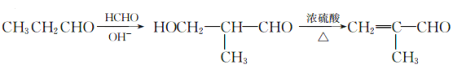 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��H2��һ�������¿��Ժϳ��Ҵ���CH3CH2OH����2CO��g����4H2��g��![]() CH3CH2OH��g����H2O��g����������������˵��������Ӧ��һ���������Ѵﵽ��ѧƽ��״̬����
CH3CH2OH��g����H2O��g����������������˵��������Ӧ��һ���������Ѵﵽ��ѧƽ��״̬����
A��CO�ڸ������´ﵽ���ת����
B������Ӧ���淴Ӧ�Ļ�ѧ��Ӧ���ʾ�Ϊ��
C����Ӧ������CO��H2��CH3CH2OH����
D����Ӧ��ϵ��H2 ��CH3CH2OH �����ʵ���Ũ��Ϊ4��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǹ���������������ϲ����ѩ������д���пհף���ѩ�˶�����������____�����Ƴɣ�����______���ص㣨д���㣩��ȥ��ѩ��ʱ����������CNGΪ��ʶ��ȼ����������������Դ��________�����ȼ��ȼ�յķ�Ӧ�Ļ�ѧ����ʽ��______________����Ӧǰ��̼Ԫ�صĻ��ϼ۷ֱ�Ϊ_______����ѩ����Χ�Ŀ�Ұ�������������������ƿ����Щ����ɫ��Ⱦ����������Σ����________(д����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������г�������A��B��������ӦaA(g)+bB(g) ![]() cC(g)����Ӧ�����У�����A�����������C������������¶ȣ�T���ı仯������ͼ��ʾ������˵����ȷ����
cC(g)����Ӧ�����У�����A�����������C������������¶ȣ�T���ı仯������ͼ��ʾ������˵����ȷ����
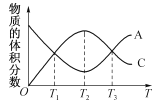
A���÷�Ӧ��T1��T3�¶�ʱ�ﵽ��ѧƽ�� B���÷�Ӧ��T2�¶�ʱ�ﵽ��ѧƽ��
C���÷�Ӧ���淴Ӧ�Ƿ��ȷ�Ӧ D�������¶ȣ�ƽ���������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������������ʱ����ͬʱ������һ�ֳ�������Ҫ������������Ư���������ƣ�NaClO2�����乤���������£�
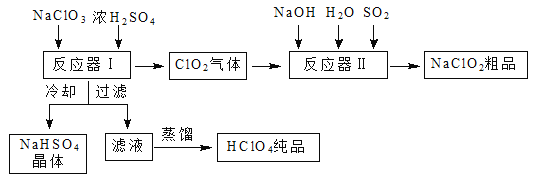
��֪���� NaHSO4�ܽ�����¶ȵ����߶������ʵ������¿ɽᾧ������
�� ������������Ϊֹ������֪���е���ǿ�ᣬ�е�90 �档
��ش��������⣺
��1����Ӧ�����з�����Ӧ�Ļ�ѧ����ʽΪ ����ȴ��Ŀ���� ��
��2����Ӧ�����з�����Ӧ�����ӷ���ʽΪ ��
��3��ͨ�뷴Ӧ�����е�SO2��H2O2����ͬ��������NaClO2�����Ҫ˵��˫��ˮ�ڷ�Ӧ���ܴ���SO2��ԭ���� ��
��4��Ca(ClO)2��ClO2��NaClO2�Ⱥ��Ȼ����ﶼ�dz��õ���������Ư������д����ҵ������Ư�۵����ӷ���ʽ�� ��
��5������Ч�Ⱥ��������������������������������������䶨���ǣ�ÿ�˺��������������������൱�ڶ��ٿ�Cl2������������ClO2����Ч�Ⱥ���Ϊ �������������λС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ѧ�о���ѧϰС����������װ����ȡ��̽�����������ʣ�A�з�����Ӧ�Ļ�ѧ����ʽ��2NH4Cl+Ca��OH��2![]() CaCl2+2NH3��+2H2O
CaCl2+2NH3��+2H2O
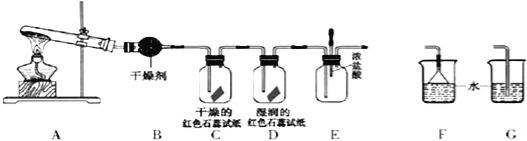
��1��Aװ�û���������ȡ ���壨ֻ��һ�֣���
��2������10.7gNH4Cl���壬������ȡNH3����״����������� L��
��3��ʵ�����ռ������ķ����� ��
��4��C��Dװ������ɫ�ᷢ���仯���� ������C������D����
��5����ʵ�����һ��ʱ���ѹEװ���еĽ�ͷ�ιܣ�����1��2��Ũ���ᣬ�ɹ۲쵽�������� ��
��6��Ϊ��ֹ����������ɿ�����Ⱦ����Ҫ������װ�õ�ĩ������һ��β������װ�ã����ʵ�װ���� ������F������G������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪K2Cr2O7��Һ�д�������ƽ�⣺Cr2O72��(��ɫ)+H2O![]() 2H��+2CrO42��(��ɫ)��
2H��+2CrO42��(��ɫ)��
����2mL0.1mol��L��1K2Cr2O7��Һ�е���3��6mol��L��1NaOH��Һ����Һ�ɳ�ɫ��Ϊ��ɫ����������Һ���ٵ���5��ŨH2SO4����Һ�ɻ�ɫ��Ϊ��ɫ��
�����ữK2Cr2O7��Һ�е�������Na2SO3��Һ����Һ�ɳ�ɫ��Ϊ��ɫ��Cr2O72��+8H��+3SO32����2Cr3+(��ɫ)+3SO42��+4H2O�����з�����ȷ���ǣ���
A��CrO42����S2����������Һ�пɴ�������
B��ʵ���˵�������ԣ�Cr2O72����SO42��
C��ϡ��K2Cr2O7��Һʱ����Һ�и�����Ũ�Ⱦ���С
D��ʵ��ٺ͢ھ���֤��K2Cr2O7��Һ�д�������ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij�о���ѧϰС�������ȡ������������Ϊ��Ӧ������ض���Ӧ��װ�ã�����Dװ���Թ���ʢ��ˮ���ձ���Ϊ��ˮԡ��

��1������a�������� ��
��2��Cװ�õ������� ��
��3��Eװ���з���������ԭ��Ӧ������CO2��HCl(g).д��������Ӧ�Ļ�ѧ����ʽ ��Dװ�õ������� ��
��4��E����Ӧ��Ϻر�����K����ȥ�����ƾ��ƣ��������ȵ����ã�A������Cl2������B�е������� ��
��5����ȡ20mlFװ������Һ�������Һ©���У�Ȼ����ע��10mlCCl4���Ǻò������������á��ֲ��ֱ�ȡ�ϲ�Һ���²�Һ�������飬������ʹ��ɫ������ɫ���� (�����ϲ�Һ�������²�Һ��)��
��6��������鷽��֤����������E�з�Ӧ��HCl(g)���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E�Ƕ�����ԭ���������������5��Ԫ�أ�Aԭ����Ԫ�����ڱ���ԭ�Ӱ뾶��С��B��Eͬ���壬��E��ԭ��������B��������C��D�ǽ��������ǵ����������������ˮ������˵������ȷ���� �� ��
A. �����ӵİ뾶��C>D>E>B
B. ��ҵ�ϳ��õ�ⷨ�Ƶ�C��D�ĵ���
C. �ȶ��ԣ� A2B>A2E
D. ����D������ұ��ijЩ���۽���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com