
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。


下列说法错误的是( )
A.0~t1时,原电池的负极是Al片
B.0~t1时,正极的电极反应式是![]() +2H++e=NO2↑+H2O
+2H++e=NO2↑+H2O
C.t1后,原电池的正、负极发生互变
D.t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
【答案】D
【解析】
0~t1时,铝为原电池的负极,铜为正极,到t1时,铝在浓硝酸中钝化后不再反应,此时铜又成了原电池的负极。
0~t1时,铝为原电池的负极,铜为正极,到t1时,铝在浓硝酸中钝化后不再反应,此时铜又成了原电池的负极。
A、0~t1时,原电池的负极是Al片,故A正确;
B、0~t1时,硝酸根离子在正极得电子生成红棕色气体NO2,正极的电极反应式是NO3-+2H++e=NO2↑+H2O,故B正确;
C、t1后,铝发生钝化,铜作负极,所以,电池的正、负极发生互变,故C正确;
D、t1后,铜是负极,每有0.3 mol电子发生转移,就有0.15 mol铜失去电子,负极质量减少9.6 g,故D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】下列有关化学实验原理、操作以及现象预测和结论的叙述正确的是
A.图1装置制备并检验氢气的可燃性
B.实验室可用图2装置制取CO2气体
C.图3装置量取8.5mL的稀硫酸
D.可用图4装置除去CO2中的HCl气体杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如下图所示装置(Ⅰ)制取溴苯和溴乙烷。

已知
(1)已知溴乙烷为无色液体,难溶于水,沸点为38.4℃,熔点为-119℃,密度为1.46 g·cm-3。
(2)CH3CH2OH+HBr![]() CH3CH2Br+H2O,
CH3CH2Br+H2O,
CH3CH2OH![]() CH2=CH2↑+H2O,
CH2=CH2↑+H2O,
2CH3CH2OH![]() C2H5—O—C2H5+H2O
C2H5—O—C2H5+H2O
主要实验步骤如下:
①检查装置的气密性后,向烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓H2SO4的混合液至恰好没过进气导管口。
③将A装置中的纯铁丝小心向下插入混合液中。
④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟。
请填写下列空白:
(1)写出A中反应的化学方程式__________________________________________________,导管a的作用是____________________。
(2)C装置中U形管内部用蒸馏水封住管底的作用是______________________________。
(3)反应完毕后,U形管中分离出溴乙烷时所用的最主要仪器的名称是(只填一种)__________。
(4)步骤④中能否用大火加热,理由是____________________。
(5)为证明溴和苯的上述反应是取代反应而不是加成反应。该同学用装置(Ⅱ)代替装置B、C直接与A相连重新反应。装置(Ⅱ)的锥形瓶中,小试管内的液体是_________________________(填名称),其作用是__________________;小试管外的液体是__________________(填名称),其作用是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,Ksp(AgCl)=1.56×10-10 mol2·L-2,Ksp(Ag2CrO4)=1×10-12 mol3·L-3,下列叙述正确的是
A. 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
B. 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
C. 向0.0008 mol/L的K2CrO4溶液中加入等体积的0.002 mol/L AgNO3 溶液,则CrO42 -完全沉淀
D. 将0.001mol/L的AgNO3 溶液滴入0.001 mol/L KCl和0.001 mol/L K2CrO4的混合溶液中,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是
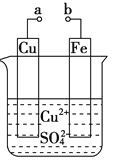
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有A12O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。

已知:i伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
ii Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-
[FeCl6]3-
(1)写出过程I中Fe2O3发生反应的离子方程式:____。
(2)过程II加入过量H2O2的作用是 ___ 。
(3)过程II加入伯胺一煤油对浸取液进行分离,该操作的名称是_____。
(4)从化学平衡角度解释过程III利用NaCI溶液进行反萃取的原理:_____。
(5) N2H4具有碱性,可与H+结合生成N2H5+。过程IV中先用过量的N2H4将水层2中Fe3+转化为Fe2+并生成N2,反应的离子方程式为____,得到的Fe2+再被O2氧化为FeOOH。
(6)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。

已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:____,
第二步:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯胺可用于合成染料Y,增加纤维着色度,乙烯胺(CH2=CHNH2)不稳定,所以聚乙烯胺常用聚合物X水解法制备。

下列说法不正确的是
A. 乙烯胺与CH3CH=NH互为同分异构体
B. 测定聚乙烯胺的平均相对分子质量,可得其聚合度
C. 聚合物X在酸性或碱性条件下发生水解反应后的产物相同
D. 聚乙烯胺和R-N=C=S合成聚合物Y的反应类型是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有c(HA)+c(A-)=0.1mol/L 的一组HA、KA 混合溶液,溶液中c(HA)、c(A-)与pH的关系如下图所示。下列叙述不正确的是

A. pH= 5.75 的溶液中: c(K+)>c(A- )>c(HA)>q(H+)>c(OH- )
B. 欲得W 点所示溶液,起始所加溶液应符合c(HA)+c(A-)=0.1mol/L 且c(KA)
C. pH=3.75的溶液中:c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L
D. 若A-的水解常数为Kb 则lgKb=-9.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的BaCl2溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na2CO3溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是
A.①②③⑤④B.③②①⑤④C.②①③④⑤D.③⑤②①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com