
| A. | 7.69mol/L 14.5% | B. | 8.15mol/L 15.4% | C. | 7.69mol/L 15.4% | D. | 8.17mol/L 14.5% |
分析 NH3溶于水后虽然大部分生成NH3•H2O,但在计算时,仍以NH3作为氨水中的溶质,设水的体积为1L,则氨气的体积为224L,由标准状况下的体积可计算氨气的物质的量,溶液质量=氨气质量+水的质量,溶液体积可由溶液的质量和密度来计算,再根据质量分数定义、物质的量浓度的定义计算.
解答 解:NH3溶于水后虽然大部分生成NH3•H2O,但在计算时,仍以NH3作为氨水中的溶质,
设水的体积为1L,氨气的体积为224L,则氨气的物质的量为:$\frac{224L}{22.4L/mol}$=10mol,
溶液的质量为:1000g+10mol×17g/mol=1170g,
溶液的体积为:$\frac{1170g}{0.9g/c{m}^{3}}$=1300mL=1.3L,
则氨水的质量分数为:w=$\frac{17g/mol×10mol}{1170g}$×100%=14.5%;
氨水的物质的量浓度为:c=$\frac{10mol}{1.3L}$=7.69 mol/L,
故选A.
点评 本题考查学生物质的量浓度和质量分数的计算,题目难度中等,溶液的体积计算是解答本题的关键也是学生解答本题的易错点,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
 某同学欲做1-氯丁烷的水解实验,并检验其中的氯元素.实验过程如下:(如图所示)在大试管中加入5mL 1mol•L-1 NaOH溶液和5mL的1-氯丁烷(1-氯丁烷的沸点为77~78℃,密度为0.886g•cm-3,易燃).水浴加热该试管10min以上,并控制加热温度在70~80℃.取两支小试管,各加入约1mL由2%的AgNO3和3mol•L-1硝酸按1:1比例组成的混合溶液,用胶头滴管吸取加热后大试管内的上层溶液,将此待测液逐滴加入其中一支小试管中,与另一支未加待测液的小试管内溶液相比,有白色的浑浊物出现,说明1-氯丁烷与NaOH溶液反应有Cl-生成,从而证明了1-氯丁烷中含有氯元素.请回答:
某同学欲做1-氯丁烷的水解实验,并检验其中的氯元素.实验过程如下:(如图所示)在大试管中加入5mL 1mol•L-1 NaOH溶液和5mL的1-氯丁烷(1-氯丁烷的沸点为77~78℃,密度为0.886g•cm-3,易燃).水浴加热该试管10min以上,并控制加热温度在70~80℃.取两支小试管,各加入约1mL由2%的AgNO3和3mol•L-1硝酸按1:1比例组成的混合溶液,用胶头滴管吸取加热后大试管内的上层溶液,将此待测液逐滴加入其中一支小试管中,与另一支未加待测液的小试管内溶液相比,有白色的浑浊物出现,说明1-氯丁烷与NaOH溶液反应有Cl-生成,从而证明了1-氯丁烷中含有氯元素.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| C. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏 | |
| D. | 除去甲烷中混有的少量乙烯:将混合气体通入酸性KMnO4溶液中洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
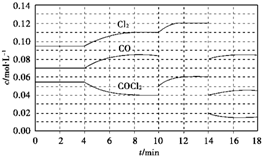
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第I A族元素的化合物 | B. | 第III A族元素的化合物 | ||
| C. | 第IV A族元素的化合物 | D. | 第VII A族元素的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A2B6 | B. | A2B3 | C. | A3B | D. | AB3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: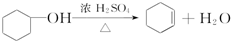
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | CHl0?ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++HPO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com