
| A、溴乙烷在浓硫酸作用下加热可制得乙烯. |
| B、在制备乙酸乙酯实验中,长导管有冷凝蒸汽和导气的作用,饱和碳酸钠溶液液面上有油状并有香味液体生成 |
| C、实验室可用无水乙醇和过量的3mol/L硫酸的混合液制乙烯 |
| D、用电石和水可制得纯净的乙炔 |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
| A、制摩尔盐时用酒精洗涤产品,制阿司匹林时用冷水洗涤产品 |
| B、培养明矾晶体时,为得到较大颗粒的晶体,应自然冷却,并静置过夜 |
| C、做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,然后用洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中,锥形瓶不需要先用醋酸溶液润洗 |
| D、铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入氢氧化钠溶液中浸泡5分钟,用水洗净后还需放入稀盐酸中浸泡,再用水洗净 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q3>Q2>Q1 |
| B、Q1>Q2>Q3 |
| C、Q1>Q3>Q2 |
| D、Q2>Q1>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Z<Y<W,而离子半径:W<Y<Z |
| B、W的氯化物水瑢液中滴加过量Z与钠形成的饱和溶液,可生成W配合物 |
| C、若由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 |
| D、已知YX3沸点远高于YZ3,则Y-X键的键能高于Y-Z键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、邻二氯苯不存在同分异构体说明苯分子中6个碳原子之间的键是完全相同 | ||||
B、若乙酸分子中的O 都是
| ||||
| C、只用溴水就可以鉴别己烯、乙酸、苯、溴苯四种无色溶液或液体 | ||||
| D、硝基、羟基、乙基等都是官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热反应不需加热即可发生 |
| B、化学反应均伴随有能量变化,这种能量变化除热能外,还可以是光能、电能等 |
| C、可燃物的燃烧热的大小与参与反应的可燃物的多少无关 |
| D、化学反应热效应数值与参与反应的物质多少有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
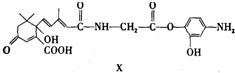
| A、X能发生氧化、取代、酯化、加聚、缩聚反应 |
| B、X与FeCl3溶液不能发生显色反应 |
| C、1mol X与足量NaOH溶液反应,最多消耗2mol NaOH |
| D、X的分子式为C23H26N2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沸点大小关系为:乙酸>水>乙醇>溴乙烷>甲醛 |
| B、在水中溶解度大小关系为:乙酸异戊酯<苯酚<乙醇 |
| C、用水可以区别苯、乙醛、四氯化碳、醋酸、硝基苯五种液体 |
| D、甲醛、乙酸任意比混合,等质量的混合物完全燃烧耗氧量和生成CO2量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com