
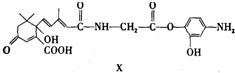
| A、X能发生氧化、取代、酯化、加聚、缩聚反应 |
| B、X与FeCl3溶液不能发生显色反应 |
| C、1mol X与足量NaOH溶液反应,最多消耗2mol NaOH |
| D、X的分子式为C23H26N2O7 |


科目:高中化学 来源: 题型:
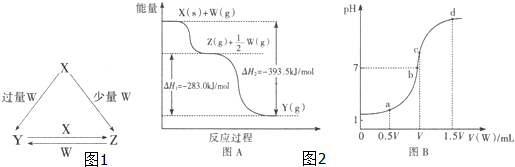
| A、酒精的燃烧热△H=-Q3 kJ?mol-1 |
| B、由③可知1mol C2H5OH(g)的能量高于2mol CO2(g)和3mol H2O(g)的总能量 |
| C、H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应 |
| D、23g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q3-0.5Q2+1.5Q1)kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
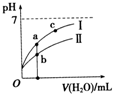 已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A、相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
| B、向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- |
| C、a、b、c三点所示溶液中水的电离程度c>a>b |
| D、图象中,I表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷在浓硫酸作用下加热可制得乙烯. |
| B、在制备乙酸乙酯实验中,长导管有冷凝蒸汽和导气的作用,饱和碳酸钠溶液液面上有油状并有香味液体生成 |
| C、实验室可用无水乙醇和过量的3mol/L硫酸的混合液制乙烯 |
| D、用电石和水可制得纯净的乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焊锡(锡铅合金)熔点比金属锡高 |
| B、油脂的皂化反应生成脂肪酸和甘油 |
| C、焰火的五彩缤纷是某些金属元素的性质的展现 |
| D、NaFeO4自身处理水的原理与明矾和漂白粉共同处理水的原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
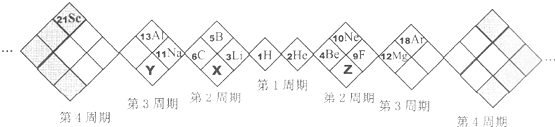
| A、X、Y、Z元素分别为N、P、O |
| B、白格中都是主族元素,灰格中都是副族元素 |
| C、原子半径:Z>X>Y |
| D、X、Y、Z的气态氢化物中最稳定的是:X的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯中含有杂质苯酚,可用浓溴水来除杂 |
B、1mol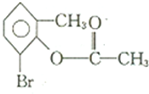 在一定条件下与足量NaOH溶液反应,最多消耗3mol NaOH 在一定条件下与足量NaOH溶液反应,最多消耗3mol NaOH |
C、按系统命名法,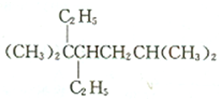 的名称为3,3,6一三甲基-4-乙基庚烷 的名称为3,3,6一三甲基-4-乙基庚烷 |
D、已知C-C键可以绕键轴自由旋转,结构简式为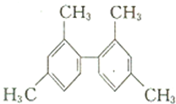 的分子中至少有11个碳原子处于同一平面上 的分子中至少有11个碳原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对钢材“发蓝”(钝化) |
| B、选用铬铁合金 |
| C、外接电源负极 |
| D、连接锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com