
【题目】已知A、B为气体单质,其中一种为黄绿色,二者反应生成气体C;D为常见金属单质,E溶液为浅绿色,它们之间有下列转化关系:

(1)写出C的溶液与D反应的离子方程式:___________。
(2)写出A通入E溶液生成F的离子方程式:___________。
(3)E溶液中含有F,除去F应加入试剂________,反应的离子反应方程式为:___________。
(4)检验F中的阳离子时,可加入试剂X的溶液,现象是:______________。X试剂的化学式是:___________________,
【答案】 Fe+2H+ = Fe2++H2↑ 2Fe2++Cl2=2Fe3++2Cl- Fe Fe+2Fe3+=3Fe2+ 呈红色 KSCN
【解析】已知A、B为气体单质,其中一种为黄绿色(黄绿色气体为氯气),得到c的溶液能与金属单质D生成浅绿色的E溶液,可知D为铁,由元素守恒可知,C是氯化氢,则E为FeCl2,B为氢气,则A为氯气,氯化亚铁被氯气氧化为F(氯化铁)。则各物质为: A、Cl2;B、H2;C、HCl;D、Fe;E、FeCl2;F、FeCl3;
(1)C的水溶液是盐酸,D是Fe,反应的离子反应方程式为:Fe+2H+=Fe2++H2↑;
(2)将氯气(A)通入氯化亚铁溶液(E)的离子反应方程式为:2Fe2++Cl2=2Fe3++2Cl-
(3)氯化亚铁溶液含有氯化铁,可加入铁粉将氯化铁还原为氯化亚铁而除去;Fe与FeCl3反应的离子方程式:2Fe3++Fe=3Fe2+;
(4)检验溶液中是否存在三价铁离子,可用KSCN溶液,Fe3++3SCN—==Fe(SCN)3,溶液呈血红色。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ、高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子,制取高铁酸钠的化学方程式如下:2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O.
(1)在上述反应中__________(元素名称)元素被氧化,氧化剂是__________(化学式)。
(2)当有2.408×1024 个电子发生转移时,参加反应的氯气在标准状况下的体积为_______。
(3)高铁酸钠(Na2FeO4)是一种新型净水剂。在水处理过程中,Na2FeO4中的铁元素转化为Fe(OH)3胶体,使水中悬浮物聚沉。向Fe(OH)3胶体中逐滴加入HCl稀溶液至过量,会出现的现象是:_______________。
II、过氧化氢H2O2 (氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2+H2O
C.2H2O2=2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是(填代号)__________________。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的叙述不正确的是( )
A. 甲烷是最简单的有机物
B. 甲烷是天然气的主要成分
C. 甲烷能与氯气在光照条件下发生反应
D. 甲烷能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量;
(2)该混合物中铝、铁的物质的量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用能量判据判断下列过程的方向的是( ).
A. 水总是自发地由高处往低处流
B. 放热反应容易自发进行,吸热反应不能自发进行
C. 有序排列的火柴散落时成为无序排列
D. 多次洗牌以后,扑克牌的毫无规律的混乱排列的概率大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝电池是重要的海洋电池之一, 以高纯铝为负极,铂铁合金为正极, 海水为电解质溶液, 工作原理如图所示。下列说法正确的是
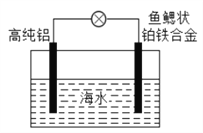
A. 正极制成鱼鳃状的目的是增大铂铁合金与海水中溶解氧的接触面积
B. 该电池工作时,铂铁合金比高纯铝更容易被腐蚀
C. 用稀硫酸代替海水有利于延长电池的使用寿命
D. 该电池可长时间进行保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次性电池。该电池反应原理如图所示,其中电解质LiC1O4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。下列说法正确的是

A. 外电路的电流方向是由Li极流向MnO2极
B. 正极的电极反应式:MnO2+Li++e-=LiMnO2
C. Li电极发生还原反应
D. 在放电过程中ClO4-向正极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.lmol·L-1的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是

A. H2A为二元弱酸,其电离方程式为:H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2-
H++A2-
B. 在0.lmolL-1NaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 在pH=1.2时,向H2A溶液中加入一定体积的0.lmo l·L-1的NaOH溶液使pH=4.2,则c(A2-)、c(HA-)、c(H2A)之和不变
D. 在 pH=3.0 时:c(A2-)+ c(HA-)<0.lmo l·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.2g由氧气和臭氧组成的混合物中含有氧原子的数目为0.3NA
B. 0.1 molL-1的FeCl3溶液中Cl-的数目为0.3NA
C. 标准状况下,11.2L苯中含有碳碳双键的数目为1.5NA
D. 1 mol Cl2与足量的铁反应转移的电子数是2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com