
【题目】下列有关说法不正确的是( )
A. 常温下,盐酸和醋酸溶液,c(Cl-)=c(CH3COO-),做导电性实验,醋酸的灯泡更亮
B. amolFeS与bmolFeO投入到VLcmol/L的稀硝酸溶液中充分反应,所得溶液成分看作Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为(3a+3b)mol
C. AgI悬浊液中加入少量KI粉末,AgI(s)![]() Ag+(aq)+I-(aq)左移,溶液中离子总浓度增大
Ag+(aq)+I-(aq)左移,溶液中离子总浓度增大
D. 由酸性溶液中MnO4-可以氧化Cl-,可知酸性溶液MnO4-也可以氧化Br-
【答案】A
【解析】A.溶液的导电性与溶液中的离子浓度和离子所带的电荷有关,常温下,盐酸和醋酸溶液中c(Cl-)=c(CH3COO-),则二者溶液中的c(H+)也相等,因此做导电性实验时,盐酸和醋酸溶液的灯泡亮度一样,故A错误;B. 若硝酸恰好反应时,amolFeS与bmolFeO被氧化生成Fe(NO3)3,根据铁原子守恒找出铁原子和硝酸的关系式:amolFeS+bmolFeO→(a+b) molFe→(a+b) molFe(NO3)3→3(a+b) molHNO3,所以未被还原的硝酸的物质的量为(3a+3b) mol,故B正确;C. AgI(s)Ag+(aq)+I(aq),在AgI悬浊液中加入少量KI粉末,平衡向左移动,因溶液中加入了K+离子,则离子的总浓度增大,故C正确;D. 因Br-还原性大于Cl-,由酸性溶液中MnO4-可以氧化Cl-,则酸性溶液中MnO4-也可以氧化Br-,故D正确;答案选A。


科目:高中化学 来源: 题型:
【题目】可逆反应:2A(s)![]() B(g)+C(g)在体积固定的密闭容器中,起始时加入一定量的A,判断反应达到平衡状态的标志是: ①单位时间内生成2molA的同时生成1molB ②v(B):v(C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变的状态
B(g)+C(g)在体积固定的密闭容器中,起始时加入一定量的A,判断反应达到平衡状态的标志是: ①单位时间内生成2molA的同时生成1molB ②v(B):v(C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变的状态
A. ①③④⑤⑥ B. ①③④⑥ C. ①④⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A.Al2(SO4)3
B.NaOH
C.BaCl2
D.FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应的原理为CO(g)+H2O(g)![]() CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
A. 单位时间内消耗2 mol的CO同时生成2 mol的CO2
B. 两个H—O键断裂的同时有一个H—H键断裂
C. 反应容器内的压强不再发生变化
D. 混合气体的相对分子质量不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质所属类型全部正确的是
A. 碱性氧化物:Na2O Na2O2 A12O3
B. 酸性氧化物:CO Si02 SO2
C. 盐:NH4N03 KA1(SO4)2 KHSO4
D. 碱:烧碱 纯碱 碱石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1) 某浓度的氨水中存在平衡:NH3·H2O ![]() NH4+ + OH-,如想增大NH4+的浓度而不增大OH-的浓度,可采取的措施是___________填字母)。
NH4+ + OH-,如想增大NH4+的浓度而不增大OH-的浓度,可采取的措施是___________填字母)。
a.适当升高温度 b.加入NH4Cl固体
c.通入NH3 d.加入少量浓盐酸
(2) 常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加适量醋酸钠晶体后,两溶液中的c(H+)变化情况是:
醋酸溶液中c(H+) _____________________(填“增大”、“减小”或“不变”),盐酸溶液中c(H+) __________________(填“增大”、“减小”或“不变”)
②加水稀释10倍后:醋酸溶液中的c(H+)________盐酸溶液中的c(H+)(填“>”、“=”或“<”)。
③加等浓度的NaOH溶液至恰好中和,所消耗的NaOH溶液体积相比较:醋酸_____________盐酸(填“>”、“=”或“<”)。
④使温度都升高20 ℃后,两溶液中c(H+)比较:醋酸____________盐酸(填“>”、“=”或“<”)。
⑤ 分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_________________(填字母,①代表盐酸,②代表醋酸溶液)。

(3) 将0.1 mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是_________________ (填字母)。
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中醋酸分子增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2+3H22NH3 , 在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
A.v(H2)=0.03 mol/(Lmin)
B.v(N2)=0.02 mol/(Lmin)
C.v(NH3)=0.17 mol/(Lmin)
D.v(NH3)=0.01 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中常用铝制炊具,它质轻且坚固耐用,其中的原因是( )
A.铝很不活泼,不易与其他物质反应
B.铝虽然很活泼,但是只有在高温下才能与其他物质反应
C.铝制品表面有一层致密的氧化物薄膜,起保护作用
D.铝制品表面镀有一层铜,可以保护铝制品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应及其应用在化学中占有重要地位。回答下列各题。
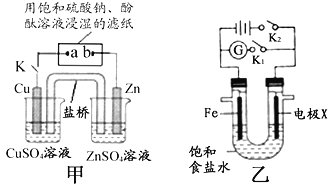
(1)写出铝与氢氧化钠溶液反应的离子方程式____________________;若将镁条、铝条和灵敏电流计用导线相连,使镁条、铝条浸入氢氧化钠溶液中,电流计指针发生偏转时,负极材料为________。
(2)当闭合K时,甲装置中Zn极的电极反应式为____;电子流动的方向为______;若盐桥中填充KCl琼脂,K+离子移动的方向为______;a极的电极反式为________;一段时间后,b极附近的现象为____________________。
(3)装置乙中。
①断开K2,接通K1。当X为石墨电极,Fe极的电极反应式为_________;当X为锌电极,Fe极的电极反应式为_____________。
②断开K1,接通K2。若X为石墨电极,X极的电极名称为_____;装置反应的离子方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com