
【题目】下面是以有机物A合成聚酯类高分子化合物F的路线:
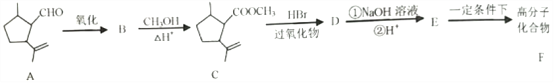
已知: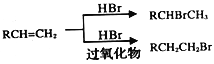
回答下列问题:
(1)C→D的反应类型为__________,C中的官能团名称为__________。
(2)D与NaOH水溶液反应的化学方程式为__________。
(3)①E生成F的化学方程式为__________。
②若F的平均相对分子质量为20000,则其平均聚合度为__________。(填字母)
A.54 B.108 C.119 D.133
(4)E在一定条件下还可以合成含有六元环状结构的G。G的结构简式为__________;满足下列条件的G的同分异构体有__________种。(不考虑立体异构)
①含有1个六元碳环且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与足量新制Cu(OH)2反应产生 2mol砖红色沉淀
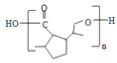
(5)参照上述合成路线,写出用![]() 为原料制备化合物
为原料制备化合物![]() 的合成路线___________。(其他试剂任选)
的合成路线___________。(其他试剂任选)
【答案】加成反应 碳碳双键,酯基 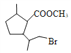 +2NaOH
+2NaOH![]()
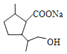 +CH3OH+NaBr
+CH3OH+NaBr 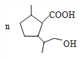
![]()
 +(n-1)H2O C
+(n-1)H2O C 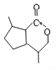 4
4 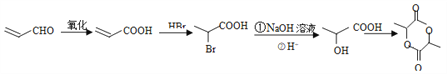
【解析】
根据流程图,结合C的结构可知,A中醛基被氧化生成羧基,B为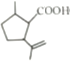 ,B与甲醇发生酯化反应生成C(
,B与甲醇发生酯化反应生成C(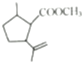 ),在过氧化钠存在时,C与溴化氢加成生成D,D为
),在过氧化钠存在时,C与溴化氢加成生成D,D为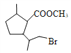 ,D在氢氧化钠溶液中水解后酸性生成E,E为
,D在氢氧化钠溶液中水解后酸性生成E,E为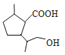 ,E在一定条件下发生缩聚反应生成高分子F,F为
,E在一定条件下发生缩聚反应生成高分子F,F为 。
。
(1)根据上述分析,C与溴化氢发生加成反应生成D,C( )中的官能团是碳碳双键,酯基,故答案为:加成反应;碳碳双键,酯基;
)中的官能团是碳碳双键,酯基,故答案为:加成反应;碳碳双键,酯基;
(2)D( )在NaOH水溶液中发生水解反应,反应的化学方程式为
)在NaOH水溶液中发生水解反应,反应的化学方程式为 +2NaOH
+2NaOH![]()
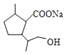 +CH3OH+NaBr,故答案为:
+CH3OH+NaBr,故答案为: +2NaOH
+2NaOH![]()
 +CH3OH+NaBr;
+CH3OH+NaBr;
(3)①E()生成F( )的化学方程式为
)的化学方程式为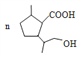
![]()
 +(n-1)H2O,故答案为:
+(n-1)H2O,故答案为:
![]()
 +(n-1)H2O;
+(n-1)H2O;
②若F的平均相对分子质量为20000,其链节的式量为168,则其平均聚合度为![]() ≈119,故选C;
≈119,故选C;
(4)E( )在一定条件下还可以合成含有六元环状结构的G。G的结构简式为
)在一定条件下还可以合成含有六元环状结构的G。G的结构简式为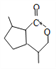 ;①含有1个六元碳环且环上相邻4个碳原子上各连有一个取代基;②1mol该物质与足量新制Cu(OH)2反应产生2mol砖红色沉淀,说明含有2个醛基,则满足条件的G的同分异构体中含有1个六元碳环、2个醛基和2个甲基,结构简式有4种,故答案为:
;①含有1个六元碳环且环上相邻4个碳原子上各连有一个取代基;②1mol该物质与足量新制Cu(OH)2反应产生2mol砖红色沉淀,说明含有2个醛基,则满足条件的G的同分异构体中含有1个六元碳环、2个醛基和2个甲基,结构简式有4种,故答案为: ;4;
;4;
(5)用![]() 为原料
为原料![]() ,可以首先合成
,可以首先合成![]() ,根据流程图中A→E的合成,只需要将
,根据流程图中A→E的合成,只需要将![]() 按照流程图中A→E的合成方法进行即可,因此合成路线为
按照流程图中A→E的合成方法进行即可,因此合成路线为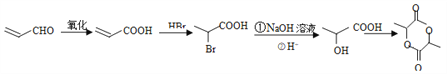 ,故答案为:
,故答案为: 。
。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】铁氮化合物(![]() )在磁记录材料领域有着广泛的应用前景。某
)在磁记录材料领域有着广泛的应用前景。某![]() 的制备需铁、氮气、丙酮和乙醇参与。
的制备需铁、氮气、丙酮和乙醇参与。
(1)![]() 基态核外电子排布式为_______。
基态核外电子排布式为_______。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______,1mol丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______,1mol丙酮分子中含有σ键的数目为______________。
(3)C、H、O三种元素的电负性由小到大的顺序为_____。
(4)乙醇的沸点高于丙酮,这是因为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液![]() 醋酸二氨合铜
醋酸二氨合铜![]() Ⅰ
Ⅰ![]() ,氨水
,氨水![]() 吸收在生产过程中产生的CO和
吸收在生产过程中产生的CO和![]() 等气体,铜液吸收CO的反应是放热反应,其反应方程式为:
等气体,铜液吸收CO的反应是放热反应,其反应方程式为:![]() ; 完成下列填空:
; 完成下列填空:
![]() 如果要提高上述反应的反应速率,可以采取的措施是 ______
如果要提高上述反应的反应速率,可以采取的措施是 ______ ![]() 选填编号
选填编号![]()
![]() 减压
减压 ![]() 增加
增加![]() 的浓度
的浓度 ![]() 升温
升温 ![]() 及时移走产物
及时移走产物
![]() 铜液中的氨可吸收二氧化碳,写出该反应的化学方程式: ______
铜液中的氨可吸收二氧化碳,写出该反应的化学方程式: ______
![]() 简述铜液吸收CO及铜液再生的操作步骤
简述铜液吸收CO及铜液再生的操作步骤![]() 注明吸收和再生的条件
注明吸收和再生的条件![]() .______
.______
![]() 铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为 ______ 通过比较 ______ 可判断氮、磷两种元素的非金属性强弱.
铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为 ______ 通过比较 ______ 可判断氮、磷两种元素的非金属性强弱.
![]() 已知
已知![]() 与
与![]() 分子结构相似,
分子结构相似,![]() 的电子式是 ______
的电子式是 ______ ![]() 熔点高于
熔点高于![]() ,其原因是 ______
,其原因是 ______
![]() 提取的
提取的![]() 中含少量
中含少量![]() 、
、![]() 将产品溶解,加入
将产品溶解,加入![]() ,加热至沸,再加入
,加热至沸,再加入![]() 溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是 ______
溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是 ______ ![]() 滤渣的主要成分是 ______ 、 ______ .
滤渣的主要成分是 ______ 、 ______ .
![]() 称取
称取![]() 小苏打样品
小苏打样品![]() 含少量
含少量![]() ,配置成250mL溶液,取
,配置成250mL溶液,取![]() 用
用![]() 盐酸滴定,消耗盐酸
盐酸滴定,消耗盐酸![]() 实验中所需的定量仪器出滴定管外,还有 ______
实验中所需的定量仪器出滴定管外,还有 ______ ![]() 选甲基橙而不选酚酞作为指示剂的原因是 ______
选甲基橙而不选酚酞作为指示剂的原因是 ______ ![]() 样品中
样品中![]() 质量分数为 ______
质量分数为 ______ ![]() 保留3位小数
保留3位小数![]()
![]() 将一定量小苏打样品
将一定量小苏打样品![]() 含少量
含少量![]() 溶于足量盐酸,蒸干后称量固体质量,也可测量定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果 ______
溶于足量盐酸,蒸干后称量固体质量,也可测量定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果 ______ ![]() 选填“偏高”、“偏低”或“不受影响”
选填“偏高”、“偏低”或“不受影响”![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种常用的抗组胺药物,一种合成路线如下:

已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3![]() HNR2+2H2O(R代表烃基)。
HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是___,H中的官能团名称是_______。
(2)由E生成F的反应类型是______,G的结构简式为______。
(3)A→B的化学方程式为_____。
(4)L是F的同分异构体,含有联苯(![]() )结构,遇FeCl3溶液显紫色,则L有___种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为_____。
)结构,遇FeCl3溶液显紫色,则L有___种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为_____。
(5)写出用氯乙烷和2-氯-1-丙醇为原料制备化合物![]() 的合成路线(其他无机试剂任选)。____
的合成路线(其他无机试剂任选)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E原子序数依次增大。已知:A、C同主族,A的原子最外层电子数是次外层的3倍,B的氧化物既能溶于强酸,又能溶于强碱,D的原子半径是第3周期中最小的,E是形成骨骼和牙齿的主要元素,且E单质能和水反应。则下列分析错误的是
A. A的离子结构示意图为![]()
B. D的最高价氧化物的水化物的酸性大于C的最高价氧化物的水化物的酸性
C. E和D形成的离子化合物ED2的电子式为![]()
D. B的氧化物为离子化合物,只含离子键,其晶体为离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含![]() 、ZnS、CuS及少量的
、ZnS、CuS及少量的![]() 。某实验小组以废催化剂为原料,回收锌和铜。设计实验流程如下:已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是
。某实验小组以废催化剂为原料,回收锌和铜。设计实验流程如下:已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是
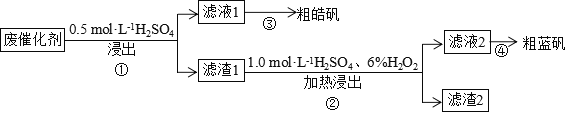
A.滤液1中是否含有![]() ,可以选用KSCN和新制的氯水检验
,可以选用KSCN和新制的氯水检验
B.步骤![]() 操作中,先加
操作中,先加![]()
![]() ,在不断搅拌下,再加入
,在不断搅拌下,再加入![]()
![]()
C.滤渣1成分是![]() 和CuS,滤渣2成分一定是
和CuS,滤渣2成分一定是![]()
D.步骤![]() 操作中,生成的气体需用NaOH溶液或
操作中,生成的气体需用NaOH溶液或![]() 溶液吸收
溶液吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃。A处为SO2气体发生装置,C处为SO2与O2反应的装置。
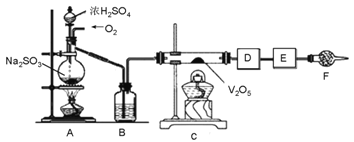
完成下列填空:
(1).A处的化学反应方程式为__________________,仪器F的名称为___________________________。
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:________________,E:______________。

(3).用amolNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间O2,最后测得E处装置增重bg,则此时SO2的转化率为_____%(用含a、b的代数式表示)。
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是____________________________________________________________________________________________。
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数,下列说法中正确的是( )
A. 53g碳酸钠中含NA个CO32—B. 0.1molOH—含NA电子
C. 1.8g重水(D2O)中含NA个中子D. 标准状况下11.2L臭氧(O3)中含NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)![]() (指出所含官能团名称)_____________________
(指出所含官能团名称)_____________________
(2)相对分子质量为72且沸点最低的烷烃的习惯名称是________________________________
(3) 写出3,3—二甲基丁酸的结构简式______________________________
(4)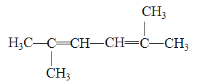 的系统命名为________________________;
的系统命名为________________________;
(5)合成高聚物![]() 其单体的键线式___________________________________
其单体的键线式___________________________________
(6)甲苯可用于制造烈性炸药TNT,该反应的化学方程式为__________________________________________
(7)某烃的结构式用键线式可表示为![]() ,若该烃与Br2发生加成反应(反应物的物质的量之比为1∶1),则所得产物(不考虑顺反异构)有__________种。
,若该烃与Br2发生加成反应(反应物的物质的量之比为1∶1),则所得产物(不考虑顺反异构)有__________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com